
题目列表(包括答案和解析)
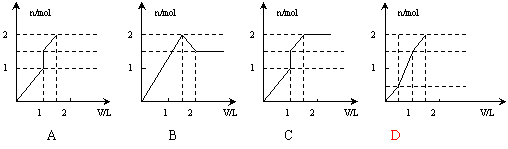
11.向含1mol HCl和1mol MgSO4的混合溶液中加入1mol·L-1的Ba(OH)2溶液,产生沉淀的物质的量(n)与加入Ba(OH)2溶液体积(V)间的关系图正确的是
10.已知:①向KmnO4晶体滴加浓盐酸,产生黄绿色气体;②向FeCl2溶液中通入少量实验①产生的气体,溶液变黄色;③取实验②生成的溶液滴在淀粉KI试纸上,试纸变蓝色.下列判断正确的是
A.上述实验证明氧化性:MnO4->Cl2>Fe3+>I2
B.上述实验中,共有两个氧化还原反应
C.实验①生成的气体不能使湿润的淀粉KI试纸变蓝
D.实验②证明Fe2+既有氧化性又有还原性
9.某溶液中大量存在以下五种离子:NO3-、SO42-、Fe3+、H+、M,其物质的量之比为
n(NO3-):n(SO42-):n(Fe3+):n(H+):n(M)=2:3:1:3:1,则M可能是
A.Fe2+ B.Mg2+ C.Cl- D.Ba2+
8.化学用语是学习化学的重要工具,下面用来表示物质变化的化学用语中,正确的是
A.氢气燃烧的热化学方程式:2H2(g)+ O2(g)=2H2O(l); △H= +570kJ·mol-1
B.甲烷碱性燃料电池的负极反应:CH4+10OH--8e-= CO32-+7H2O
C.饱和FeCl3溶液滴入沸水中的反应:FeCl3+3H2O = Fe(OH)3↓+3HCl↑
D.铝片溶于氢氧化钠溶液:Al+2OH-=AlO2-+H2↑
7.设NA表示阿伏加德罗常数的值,下列说法中不正确的是
A.如果5.6L N2含有n个氮分子,则阿伏加德罗常数一定约为4n
B.15.6g Na2O2与过量CO2反应时,转移的电子数为0.2 NA
C.在一定条件下,6.4g SO2与足量O2反应生成SO3的分子数为0.1NA
D.T℃时,1 L pH=6纯水中,含10-6NA个OH-
6.2004年,美国科学家通过"勇气"号太空车探测出火星大气中含有一种称为硫化羰(化学式为COS)的物质。已知硫化羰分子中所有原子最外层均满足8电子结构。下列说法正确的是
A.硫化羰是酸性氧化物 B.硫化羰结构式为S=C=O
C.硫化羰属于非极性分子 D.硫化羰为分子晶体,沸点比CO2低
29.(12分)
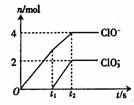 一定量的石灰乳中通入一定量的氯气,两者恰好完全反应,生成
一定量的石灰乳中通入一定量的氯气,两者恰好完全反应,生成
物中有三种含氯元素的离子,其中两种离子的物质的量(n)与反应时间(t)的曲线图如图所示。试回答:
(1)t2时Ca(ClO)2与Ca(ClO3)2的物质的量之和为________mol,该
石灰乳中Ca(OH)2的质量是________g。
(2)据分析,生成Ca(ClO3)2的反应是由温度升高引起的,通气速率不同,ClO-和ClO3-的比
例也不同,若在原石灰乳中通入氯气速率加快,则反应后n(ClO-)/n(ClO3-)将______(填“>”“<”或“=”)2,若n(ClO-)/n(ClO3-)=a,则n(Cl-)=_________________mol(用a的代数式表示)。
28.(19分)
Ⅰ.(10分)下表列出了前20号元素中的某些元素性质的有关数据:
|
元素编号 元素性质 |
① |
② |
③ |
④ |
⑤ |
⑥ |
⑦ |
⑧ |
⑨ |
⑩ |
|
原子半径 (10-10m) |
1.52 |
2.27 |
0.74 |
1.43 |
0.77 |
1.10 |
0.99 |
1.86 |
0.75 |
0.71 |
|
最高价态 |
+1 |
+1 |
- |
+3 |
+4 |
+5 |
+7 |
+1 |
+5 |
- |
|
最低价态 |
- |
- |
-2 |
- |
-4 |
-3 |
-1 |
- |
-3 |
-1 |
试回答下列问题:
(1)以上10种元素形成的单质中,与水反应最剧烈的金属是 (填写编号)。
 (2)上述⑤、⑥、⑦三种元素中的两种元素形成的化合物中,每个原子都满足最外层为8电子稳定结构的物质的化学式为
。
(2)上述⑤、⑥、⑦三种元素中的两种元素形成的化合物中,每个原子都满足最外层为8电子稳定结构的物质的化学式为
。
(3)某元素R的原子半径为1.02×10-10m,该元素是 ;化合物Na2R2的电子式为_____________________。
(4)元素⑤的某种单质具有平面层状结构,同一层中的原子构成许许多多的正六边形,此单质与熔融的②单质相互作用,形成某种青铜色的物质(其中的元素②用“●”表示),原子分布如图所示,该物质的化学式为 。
Ⅱ.(9分)A、B、C、D均为4种常见的短周期元素,常温下A、B可形成两种常见的液态化
合物,其最简式分别为BA和B2A;B与D可形成分子X,也可形成阳离子Y,X、Y在水溶
液中酸碱性正好相反;C+的焰色反应呈黄色。
⑴液态X类似B2A,也能微弱电离且产生电子数相同的两种离子,则液态X电离方程式为 。
⑵M、N是由A、B、C、D四种元素中任意三种元素组成的不同类型的强电解质,M的水溶液呈碱性,N的水溶液呈酸性,且M溶液中水的电离程度小于N溶液中水的电离程度。 则M、N分别为(填化学式)___________________;若将0.1mol·L-1M和0.2mol·L-1N两溶液等体积混合所得溶液中离子浓度的大小顺序为____________________________________。
27.(12分)
下图表示各物质之间的转化关系。已知:A、B、I都是XY2型化合物,且阳离子相同,A、B晶体中阴、阳离子个数比都是1∶1,但I晶体中阴、阳离子个数比是2∶1,I常用作干燥剂。
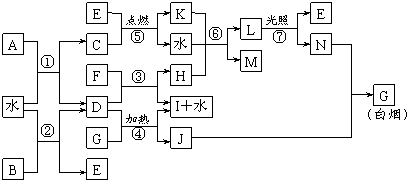
请按要求填空:
⑴G属于_________晶体。
⑵反应⑥的化学方程式是_________________________________________________。
⑶已知C的燃烧热是1300 kJ·mol-1,表示C的燃烧热的热化学方程式是_____________。
⑷根据上图中物质之间的转化关系及题中所给信息判断,B的化学式是_________。
26.(17分)
Ⅰ.(6分)下列有关化学实验的操作或说法中,正确的是(填写字母代号)_________。
A、配置硫酸铜溶液时应向溶液中加入少量的铜粉
B、进行中和热测定实验时,需要测出反应前盐酸与NaOH溶液的各自温度及反应后溶液的最高温度
C、向某溶液中先通入Cl2再滴加KSCN溶液时溶液变红,证明该溶液一定含有Fe2+
D、制备硫酸亚铁晶体时,向稀硫酸中加入废铁屑至有少量气泡发生时,过滤,然后加热蒸发滤液即可得到硫酸亚铁晶体
E、FeCl3溶液能使淀粉碘化钾试纸变蓝,故能用淀粉碘化钾试纸鉴别黄色的FeCl3溶液和溴水
F、实验室制取肥皂时,将适量植物油、乙醇和NaOH溶液混合,并不断搅拌、加热,直到混合物变稠,即可得到肥皂
Ⅱ.(11分)今有下列气体:①H ②Cl
②Cl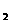 ③CH
③CH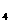 ④HCl ⑤NH
④HCl ⑤NH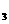 ⑥NO ⑦H
⑥NO ⑦H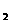 S ⑧SO
S ⑧SO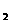 ,用
,用
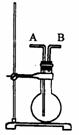 右图所示装置进行实验。
右图所示装置进行实验。
请写下列空白:
(1)当烧瓶干燥时,从B口进气可收集的气体是(填序号)_____________。
(2)当烧瓶干燥时,从A口进气可收集的气体有______种。
(3)若烧瓶充满水,可收集的气体有(填序号)______;此时气体由____口进入。
(4)若烧瓶内装入浓H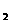 SO
SO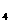 进行气体干燥,不能用此装置干燥的气体有(填序号)________。
进行气体干燥,不能用此装置干燥的气体有(填序号)________。
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com