
题目列表(包括答案和解析)
25、某课外兴趣小组决定开展研究,寻求可行的方法,鉴别某样品是亚硝酸钠还是氯化钠。为解决这一问题,该小组查阅了大量的资料,对亚硝酸钠的性质做如下归纳:亚硝酸钠,化学式为NaNO2,是亚硝酸(HNO2,一种弱酸)的钠盐;白色粉末,易溶解在水中,有毒,容易潮解。由于亚硝酸钠中的氮元素处于中间价态,既有氧化性(在酸性条件下会氧化KI,得到碘单质),又有还原性(在酸性条件下,会被KMnO4酸性氧化),大量用于防锈、印染……
甲设计方案如下:取少量固体,配成溶液。往溶液中滴加少量KMnO4酸性溶液,观察溶液是否褪色。如果褪去,说明该样品为亚硝酸钠。反应表达式为:
______MnO +______NO
+______NO +______H+====______Mn2+______NO
+______H+====______Mn2+______NO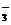 +______H2O。
+______H2O。
(1)配平上述离子方程式。
(2)甲认为他的方案还可测定样品中亚硝酸钠的含量(假设该样品只含有NaNO3和NaNO2)。过程如下:
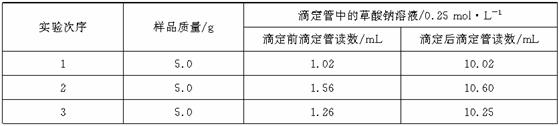
Ⅰ、称一定量样品,溶于水置于锥形瓶中;Ⅱ、取0.10 mol·L-1 的KMnO4酸性溶液25.00 mL(过量)倒入锥形瓶中,振荡;Ⅲ、用草酸钠溶液滴定过量的KMnO4酸性溶液;Ⅳ、重复上述操作。各次实验数据如下:
 已知:2MnO
已知:2MnO +5C2O
+5C2O +16H+=2Mn2++10CO2↑+8H2O。试计算样品中NaNO2的质量分数(必须列出计算过程,小数点后保留两位数字)。
+16H+=2Mn2++10CO2↑+8H2O。试计算样品中NaNO2的质量分数(必须列出计算过程,小数点后保留两位数字)。
高三教学质量检测
化学试题答题卷 姓名 学号
选择题一、二(共64分)
|
1 |
2 |
3 |
4 |
5 |
6 |
7 |
8 |
|
|
|
|
|
|
|
|
|
|
9 |
10 |
11 |
12 |
13 |
14 |
15 |
16 |
|
|
|
|
|
|
|
|
|
24、有一瓶白色固体,取少量置于试管中加热,固体逐渐消失,放出水蒸气和其他两种气体,试管内除管口有少量水珠外,没有任何残留物.取0.350g这种固体跟过量的碱液反应,生成一种能使湿润红色石蕊试纸变蓝的气体,这些气体正好能和30.0mL 0.1mol/L硫酸完全反应;另取0.350g该固体跟足量的盐酸反应,放出一种无色无臭气体,将这些气体通入过量的澄清石灰水,得到0.400g白色沉淀。
(1)计算0.350g该固体中含有的阴离子和阳离子的物质的量。
(2)根据实验及计算结果确定白色固体是什么?写出判断的依据。
(二)证明氧化铜能加快氯酸钾的分解并与二氧化锰的催化效果进行比较
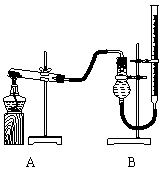 用右图装置进行实验,实验时均以生成25 mL气体为准,其它可能影响实验的因素均已忽略,相关数据见下表:
用右图装置进行实验,实验时均以生成25 mL气体为准,其它可能影响实验的因素均已忽略,相关数据见下表:
|
实验序号 |
KClO3质量 |
其它物质质量 |
待测数据 |
|
④ |
1.2 g |
无其他物质 |
|
|
⑤ |
1.2 g |
CuO
0.5 g |
|
|
⑥ |
1.2 g |
MnO2 0.5
g |
|
回答下列问题:
⑶上述实验中的“待测数据”指_____________;
⑷本实验装置图中量气装置B由干燥管、乳胶管和50 mL滴定管改造后组装而成,此处所用滴定管是___________(填“酸式”或“碱式”)滴定管;
⑸若要证明实验⑤中干燥管内收集的气体是O2,可待气体收集结束后,用弹簧夹夹住B中乳胶管,拔去干燥管上单孔橡皮塞,__________________________________________ ___________________________________ _________________;
⑹为探究CuO在实验⑤中是否起催化作用,需补做如下实验(无需写出具体操作):
a、_______________________________,b、 。
20、有四种同主族物质,它们的沸点(℃,1.01×105pa)如下表所示:
|
① |
He -268.8 |
Ne -249.5 |
Ar
(x) |
Kr -151.7 |
|
② |
F2
-187.0 |
Cl2
-33.6 |
(a) 58.7 |
I2
184.0 |
|
③ |
HF
(y) |
HCl -84.0 |
HBr -67.0 |
HI -35.3 |
|
④ |
H2O
(z) |
H2S
-60.2 |
(b) -42.0 |
H2Te -1.8 |
试根据上表回答:
⑴a为 色液体;b的分子式是:
⑵写出②系列中物质主要化学性质的递变规律(任定一种): ;能够说明该递变规律的化学事实是: ;(任举一例,用离子方程式表示)
⑶除极少数情况外,上述四种系列中物质的沸点与相对分子质量之间均存在一定的关系,该关系是:
⑷上表中,和两种物质的沸点较同系列其他物质反常,反常的主要原因是
21、在现代生活中,人们越来越注意微量元素的摄入。碘元素对人体健康有着至关重要的作用。为预防碘缺乏病,我国卫生部规定每千克食盐中应含有40~50 mg KIO3。回答下列问题:
(1)加碘食盐的包装袋上通常标有如下食用建议:勿长时间炖炒。其包含的原理是
(2)KIO3可用电解的方法制得,原理是:以石墨为阳极,以不锈钢为阴极,在一定温度和电流下电解KI溶液。总反应方程式为KI+3H2O===KIO3+3H2↑,则两极的电极反应式分别为:阴极_____________________,阳极______________________。
(3)为检验某食盐中是否含有KIO3,某同学取食盐样品428 g完全溶解于水中,然后加入用盐酸酸化的淀粉-KI溶液,结果溶液呈蓝色,则反应的离子方程式为__________________。为进一步确证样品是否为合格产品,该同学又用0.030 mol·L-1的Na2S2O3溶液滴定,当用去18.00 mL时蓝色刚好褪去(反应方程式为I2+2S2O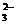 ===2I-+S4O
===2I-+S4O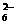 ),由此可判定该加碘食盐为 ______________(填“合格”或“不合格”)产品。
),由此可判定该加碘食盐为 ______________(填“合格”或“不合格”)产品。
22、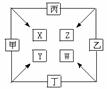 甲、乙、丙、丁四种单质在点燃条件下反应生成X、Y、Z、W四种化合物,转化关系如图所示,又知:
甲、乙、丙、丁四种单质在点燃条件下反应生成X、Y、Z、W四种化合物,转化关系如图所示,又知:
①甲、乙、丙均为前三周期元素的单质,常温下均为气态;丁是日常生活中的一种常见金属。
②常温下,X是无色液体,Y是黑色固体,
③丙在乙中燃烧发出苍白色火焰,丁在乙中燃烧生成棕黄色的烟,W的水溶液呈黄色。
请填空:
(1)丁在甲和X同时存在的条件下,可以被腐蚀,写出电极反应方程式:
负极: 正极: 。
(2)将少量W的浓溶液滴入热的X中,反应的化学方程式为: 。
(3)将Y看成碱性氧化物,Y与Z的溶液发生反应的离子方程式是: 。
(4)若一定条件下丁分别与X、Z发生反应生成等物质的量的气体,则消耗丁的物质的量之比为 。
23、下图是某药物中间体的结构示意图:
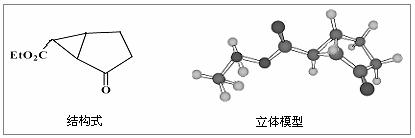
试回答下列问题:
⑴观察上面的结构式与立体模型,通过对比指出结构式中的“Et”表示 ;该药物中间体分子的化学式为 。
⑵请你根据结构示意图,推测该化合物所能发生的反应及所需反应条件 。
⑶解决有机分子结构问题的最强有力手段是核磁共振氢谱(PMR)。有机化合物分子中有几种化学环境不同的氢原子,在PMR中就有几个不同的吸收峰
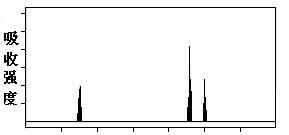
现有一种芳香族化合物与该药物中间体互为同分异构体,其模拟的核磁共振氢谱图如上图所示,试写出该化合物的结构简式: 。
(一)制取氧化铜
①称取2 gCuSO4·5H2O研细后倒入烧杯,加10 mL蒸馏水溶解;
②向上述CuSO4溶液中逐滴加入NaOH溶液,直到不再产生沉淀,然后将所得混合物转移到蒸发皿,加热至沉淀全部变为黑色;
③将步骤②所得混合物过滤、洗涤,晾干后研细备用。
回答下列问题:
⑴上述实验步骤中需要使用玻璃棒的是_______________(填实验序号),步骤①、③中研磨固体所用仪器的名称是___________________;
⑵步骤③中洗涤沉淀的操作是______________________________________________
17、根据测定硫酸铜晶体中结晶水含量的实验,填写下列空白:
(1) 有下列仪器,本实验中需要的仪器是(填写字母) ,除上述仪
器外,还需要的仪器是(填仪器名称): ;
A.带砝码的托盘天平 B.研钵 C.试管夹 D.酒精灯 E.蒸发皿
F.玻璃棒 G.坩埚 H.干燥管 I.石棉网 J.三角架
(2)本实验至少需要加热 次,至少需要称量 次;
(3)某学生实验得到以下数据:加热前容器的质量为m1,容器和晶体的总质量为m2,加热后容器和无水CuSO4的总质量为m3。请写出结晶水含量(ω)的计算公式并求出CuSO4·nH2O中n的值(用ml、m2、m3表示):ω= ,n = ;
(4)若ml = 5.4g、m2 = 7.9g、m3 = 6.8g,该生结果 (填“偏高”或“偏低”)?
从下列分析中选出该生实验产生误差的原因可能是(填写字母) 。
A、加热前称量时容器未完全干燥 B、最后两次加热后的质量差大于0.1g
C、加热后容器未放在干燥器中冷却 D、加热过程中有少量晶体溅出
 E、加热后的粉末中有少量黑色固体
E、加热后的粉末中有少量黑色固体
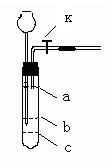
18、现有一套简易的气体发生装置(如右图所示,
其中活塞已打开)。
(1) 甲、乙两同学分别设计了如下实验方案以检验其气密性是否良好。
甲:把导气管插入一盛水的水槽中,双手捂住试管外壁, 过一会儿,
若看到试管末端有气泡冒出,松开手后又看到导管内有一段水柱,
则说明该装置的气密性良好。
乙:往漏斗中注入一定量的水,直到浸没长径漏斗下端。然后关闭活塞K,用手捂住试管
中上部(气体部分),一会儿若看到漏斗液面上升到一定高度,再重新打开活塞让液面回落,
并迅速关闭活塞K,松开手,又看到漏斗中液面低于试管中液面且不再升降。则说明该装
置气密性良好。
①甲、乙的设计方案中不可行的是 (填“甲”、“乙”或“甲和乙”),理由是: 。
②丙同学认为,只要往漏斗中加水,便可检验其气密性是否良好。经检验他的方案是可行的。则他的方案是: 。
(2) 若用该装置制取氢气,反应原理为:Zn + H2SO4 = ZnSO4 + H2↑。
试简述其实验操作步骤:
。
(3)若要将上述装置改成可随时控制反应和停止的气体发生装置,则需在试管里增设一带
小孔隔板,你认为隔板应装在 (填a、b、或c)处。
19、某实验小组欲制取氧化铜并证明氧化铜能加快氯酸钾的分解,进行了如下实验:
16、已知相同温度时,同浓度的HCO 的电离程度大于HS-的电离程度。将0.1
mol·L-1的盐酸缓慢滴入0.1
mol·L-1 的Na2S溶液中,当等体积混合后,溶液中下列粒子浓度的大小关系正确的是
( )
的电离程度大于HS-的电离程度。将0.1
mol·L-1的盐酸缓慢滴入0.1
mol·L-1 的Na2S溶液中,当等体积混合后,溶液中下列粒子浓度的大小关系正确的是
( )
A.c(Cl-)>c(HS-)>c(H+)>c(OH-) B.c(Cl-)>c(H2S)>c(HS-)>c(OH-)
C.c(Cl-)>c(HS-)>c(H2S)>c(S2-) D.c(Cl-)>c(S2-)>c(HS-)>c(H+)
第II卷(86分)
15、下列画有横线的物质在反应中不能完全消耗的是 ( )
A、将含少量CO2的CO气体通入盛有足量的Na2O2的密闭容器中,并不断用电火花引燃
B、将1mol Mg置于10L空气中(标况),使之在高温下反应
C、将1mol Cu置于含2mol H2SO4的98%的浓硫酸中加热
D、在强光持续照射下,向过量的Ca(ClO)2悬浊液中通入少量CO2
14、分别配制H3PO4、KOH的乙醇溶液,取10 mL H3PO4乙醇溶液后不断振荡并滴加KOH乙醇溶液,立即产生白色沉淀,并不断增多,继而又逐渐减少至消失,然后又逐渐增多至一定量不再消失。以上事实说明 ( )
A、K2HPO4不溶于无水乙醇 B、KH2PO4、K3PO4不溶于无水乙醇
C、KH2PO4、K2HPO4不溶于无水乙醇 D、K2HPO4溶于无水乙醇
13、下列各项实验操作正确的是 ( )
A、实验室规定:所有实验剩余的药品均不应放回原药品瓶内
B、为了加快过滤速率,可用玻璃棒搅拌过滤器中的液体
C、在转移固体需使用玻璃棒
D、为了防止容量瓶漏水,可在玻璃塞上涂上凡士林
12、设NA表示阿伏加德罗常数,下列叙述中正确的是 ( )
A、1mol金刚石晶体中含碳碳键数为4 NA
B、常温常压下,32克的O2和O3混合气体中氧原子数为2NA
C、标准状况下,22.4LSO3中含有的氧原子数约为3 NA
D、1molH2O2与足量SO2反应转移的电子数2NA
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com