
题目列表(包括答案和解析)
21. 钨是我国丰产元素 , 是熔点最高的金属 , 广泛用于拉制灯泡的灯丝 , 有 " 光明使者 " 的美誉。
钨在自然界主要以钨 (VI) 酸盐的形式存在。有开采价值的钨矿石是白钨矿和黑钨矿。 白钨矿的主要成分是钨酸钙 (CaW04); 黑钨矿的主要成分是铁和锰的钨酸盐 , 化学式常写成
(Fe,Mn)W04。黑钨矿传统冶炼工艺的第一阶段是碱熔法 :

其中 A 、 B 、 C 都是钨的化合物。
(1) 写出上述流程中 A 、 B 、 c 的化学式。
(2) 钨冶炼工艺的第二二阶段则是用碳、氢等还原剂把氧化钨还原为金属钨。对钨的纯度
|
要求不高时 , 可用碳作还原剂。写出用碳还原氧化钨制取金属钨的化学方程式。为了获得可以拉制灯丝的高纯度金制灯丝的高纯度金属钨,不宜用碳而必须用氢气作还原剂 ,为什么 ? (3)仲钨酸的阱盐在热分解时会发生内在氧化还原反应 ,我国钨化学研究的奠基人顾冀东先生采用这一反应制得了监色的、非整比的钨氧化物 WO3-x。 这种监色氧化钨具有比表面大、易还原的优点 , 在制钨粉时温度容易控制 ,目前冶炼拉制钨丝的金属钨都用蓝色氧化钨为原料。经分析 , 得知蓝色氧化钨中钨的质量分数为 0.7985。 ①计算 W03-x中的x值。 ②一般认为,蓝色氧化钨的颜色和非整比暗示了在化合物中存在五价和六价两种价态 的钨。试计算蓝色氧化钨中这两种价态的钨原子数比。 ( 相对原子质量 : W: 183.84 0: 16.00) |
|
六、 ( 本题包括 2 小题 , 共 16 分) 22. (4 分 ) 某共价化合物含 C 、 H 、 N三 元素 , 分子内有 4 个 N 原子 , 且 4 个 N 原子排列 成内空的四面体 ( 如白磷分子结构 ), 每两个 N 原子间都有一个 C 原子 , 分子内无 c-c 单 键和 c=c 双键。 (1) 试确定该化合物的分子式 : (2) 假若某大分子 , 分子内只含 C 、 H 、 P 二种元素 , 其最小的重复的结构单元可以表示为: |
|
23.
(12 分 ) 己知 : 下列各种物质都由短周期元素组成 , 它们之间的关系如下图所示。 |
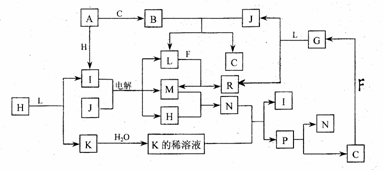
|
常温下 ,A 、 F 为金属单质 , F 既能与 L 溶液反应, 又能与 N 溶液反应。 C、 H 、 M 为 |

当该化合物分子中含n个磷原子时,则该化合物的组成可表示为:
|
气体单质 , 其中 H 呈黄绿色 ,A 、 B 、 I 、 K 、 L 、 R 的焰色反应均呈黄色。请回答 : (l)p 的结构式为 ; B 的电子式为 (2)R水溶液呈碱性的原因可用离子方程式表示为 (3)还有一种物质能与B反应生成C.写出这个反应的化学方程式 (4)还有一种物质能与j反应生成C,写出这个反应的化学方程式 (5)某气体Q具有漂白作用,将Q与H等物质的量通入水中所得溶液没有漂白作用 ,写出发生的离子反应方程式 七、(本题包括2小题,共18分) 24. (8 分 ) 将一块部分被氧化的金属钠固体(假设氧化产物只有Na202) 入盛满水且倒置水槽内的容器中,此时在容器中可收集到448ML(STP)气体(假定各步反应完全,并产生的所有气被全部被收集到容器中 ), 以电火花引燃容器里的气体 , 最终剩余112ML(STP)气体。求固体中钠及 Na202 的物质的量。 |
|
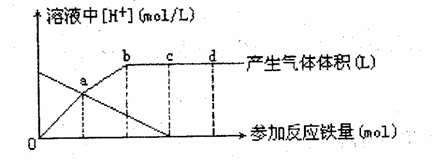
25. (10 分 ) 铁与稀硝酸作用时 , 还原产物除与稀硝酸浓度有关外 , 还与温度有关。己知在铁与冷稀硝酸反应时 , 主要还原产物为 NO 气体 : 在与热的稀硝酸作用时 , 主要还原 产物为 N20
气体 : 当 HN03 更稀时 , 其重要还原产物是 NH4+ 。现有铁与稀硝酸的作用 , 请分析原因 , 回答有关问题。 |
|
图 10-3 |
|
假设曲线的各段内只有一种还原产物。 (l)a 点到 b 点的还原产物是 ,其原因是 (2) 试完成 b点到c点的反应放程式:□Fe+□HN03-□Fe(N03)3+□□+□H20 (3)反应过程中,到达 点时 HN03 已完全反应。 (4) 己知达到 d 点时,反应结束,此时溶液中的主要阳离子是 (5)c点和d点参加反应的铁的物质的量之比是 |
20.(10分)下图是元素周期表中的前四周期 , 回答下列问题 :
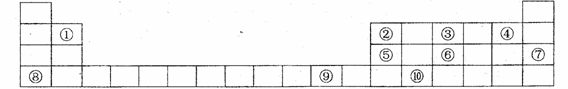
(1)②、④2种元素形成的化合物与⑤的氢化物均为AB3型,但这2种化合物分子的空
间构理明显不同。②、④2种元素形成的化合物分子的空间构型为 ,⑥的氢
化物分子的空间构型为 。 这2种化合物分子空间构型不同的原因是
(2) 元素⑩的单质 (选填"能"、"不能")和强碱溶液反应。如选"能",请写出
元素⑩的单质和强碱溶液反应的离子方程式; 如选 " 不能 ", 请说明理 由
(3)元素⑦和⑨的单质的晶体类型分别是 、
19. (8 分 ) 己知四种强电解质溶液,分别含有下列阴、阳离子中的各一种,并且互不重复:
|
NH+4 、Ba2+
、 Na+ 、H+、SO42-、NO-3、OH-、CO32- |
将这4种溶液分别标记为A、B、C、D
进行如下实验 :
① 在A或D中滴入C,均有沉淀生成
② D和B反应生成的气体能被A吸收
③ A和D反应生成的气体能被B吸收
试回答下列问题 :
(1) D的化学式是 , 判断理由是
(2) 写出其余几种物质的化学式 : A B C
(3) 写出实验②中有关反应的离子方程式
在圆底烧瓶底部,有一用塑料网包住的过量块状碳酸钙150mL饱和氯水 ,按如图
所示装置实验,待不再产生气泡后,将塑料网中剩余的石灰石提出液面,密封后再加热、煮沸烧瓶中的液体,直到重筒中的气体不再增加。

请回答 :
(3)为减少用装置III收集气体过程中CO2因溶解而造成的损失 ,且水槽中仍然为水,请
你对装置 III 进行改进 ,
最简单的方法是
(4) 用改进后的装置进行仁述实验,测得塑料网内的碳酸钙质量减少Ag,总共收集到
标准状况下的CO2气体BL,发现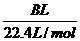 明显小于
明显小于 。若不考虑实验操作和 CO2
。若不考虑实验操作和 CO2
的溶解等因素造成的误差,从化学反应原理来看,导致这一大小关系的原因是
(5) 实验后发现 ,装置II中的液体增多了,其原因是
①在试管中加入过量的块状碳酸钙 , 再加入约 20mL 饱和氯水 , 充分反应 , 有少量气
 泡产生 , 溶液浅黄绿色褪去 :
泡产生 , 溶液浅黄绿色褪去 :
②过滤 , 将滤液滴在有色布条上 , 发现其比氯水的漂白性更强 :
③为了确定反应产物 , 将滤液分为三份 , 分别进行以下实验 :
第一份与石灰水混合 , 立即产生大量白色沉淀 :
 第二份与稀盐酸混合,立即产生大量无色气体;将第三份加热,看到溶液变浑浊且有大量无色气体产生。经检测,上述实验中产生的无色气体均为C02 请问答 :
第二份与稀盐酸混合,立即产生大量无色气体;将第三份加热,看到溶液变浑浊且有大量无色气体产生。经检测,上述实验中产生的无色气体均为C02 请问答 :
(1) 反应后所得的溶液漂白性增强的原因是
(2) 依据上述实验可推知 , ②的滤液中的溶质除CaCl2、HCIO外,还含有)
18.(12分)饱和氯水与石灰石的反应是制取较浓HClO溶液的方法之一。 2005年的《化学教育》
报道了如下实验研究 :
17.(10分)使用常用仪器,运用化学原理进行巧妙的设计,就可以用同一个简单的装
置实现多种用途。


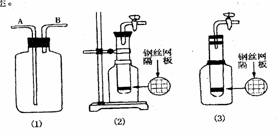
(1)利用上图中(1)装置,用两种不同类的方法分别收集NO,试简述操作方法 :
,
(2) 甲同学把试管底部钻出一小洞 ,并和广口瓶组成上图中(2)装置,通过开、关导管上的阀门可以控制试管内的反应随时发生或随时停止。如果该装置中的隔板是用铜丝制成,则该装置可以制取的常见气体有 。( 至少有两种 )
(3) 乙同学认为,可把(2)装置做如上图(3)的改动,用橡皮塞替代铁架台来固定试管。请判断乙同学的做法是否可行 ?
理由是
16. 下列关系图中,A是一种正盐 ,B是气态氢化物,C是单质,F是强酸。当X无论是强酸还是强碱时都有如下转化关系(其他产物及反应所需条件均已略去),当X是强碱时,过量的B跟Cl2反应除生成C 外, 另一产物是盐酸盐。
下列关系图中,A是一种正盐 ,B是气态氢化物,C是单质,F是强酸。当X无论是强酸还是强碱时都有如下转化关系(其他产物及反应所需条件均已略去),当X是强碱时,过量的B跟Cl2反应除生成C 外, 另一产物是盐酸盐。

下列说法正确的是:
A.当X是强酸时,A、B、C、D、E、F中均含同一种元素,F可能是H2SO4
B.当X是强碱时,A、B、C、D、E、F中均含同一种元素,F是HNO3
C.B和CL2的反应是氧化还原反应
D.当X是强酸时,C在常温下是气态单质
第 II 卷
15.A不M为两种元素,已知A位于短周期,且A2与M+的电子数之差为8,则下列说法中正确的是:
A. A 和 M 的原子序数之差为 8
B. A 和 M 原子的电子总数之和可能是 11
C. A 和 M 原子的最外层电子数之和为 8
D. A 和 M 原子的最外层电子数之差为 5
14.向胶体中加入电解质,能使胶体凝聚。使一定量的胶体在一定时间内开始凝聚所需电解质的浓度(mol/L)称作"聚沉值"。电解质的聚沉值越小,则表示其凝聚能力越大 , 实验证明,凝聚能力主要取决于胶粒带相反电荷的离子所带的电荷数,电荷数越大, 凝聚能力越大,则向Fe(OH)3胶体中加入下列电解质时,其"聚沉值"最小的为:
A. NaCI B. FeCI, C. K2SO4 D. Na3PO4.
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com