
题目列表(包括答案和解析)
5.已知:H2O (g) = H2O (l);△H = Q1 kJ/mol
C2H5OH (g) = C2H5OH (l);△H = Q2 kJ/mol
C2H5OH (g) + 3O2 (g) =2CO2 (g) + 3H2O (g) ;△H = Q3 kJ/mol
若使23g 酒精液体完全燃烧,最后恢复到室温,则放出热量为
A.Q1+ Q2 +Q3 B.0.5(Q1 + Q2 +Q3)
C.0.5Q1 -1.5Q2 + 0.5Q3 D.1.5Q1 -0.5Q2 + 0.5Q3
4.根据热化学方程式:S(s)+O2(g)=SO2(g);△H=-297.23 kJ/mol ,下列说法正确的是:
A.1molSO2 (g)的能量总和大于1molS(s)和1mol O2(g)的能量总和
B.1molSO2(g)的能量总和小于1molS(s)和1molO2(g)的能量总和
C.S(g)+O2(g)=SO2(g);△H= -Q kJ/mol ; Q的值大于297.23
D.S(g)+O2(g)=SO2(g);△H= -Q kJ/mol ; Q的值等于297.23
3.强酸和强碱稀溶液的中和热可表示为:
H+(aq)+OH-(aq)=H2O(1);ΔH=-57.3kJ·mol-1
已知:CH3COOH(aq)+NaOH(aq)=CH3COONa(aq)+H2O(1);ΔH1
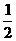 H2SO4(浓)+NaOH(aq)=
H2SO4(浓)+NaOH(aq)=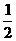 Na2SO4(aq)+H2O(1);ΔH2
Na2SO4(aq)+H2O(1);ΔH2
HNO3(aq)+KOH(aq)=KNO3(aq)+H2O(1);ΔH3
上述反应物除已注明的外均为稀溶液,则ΔH 1、ΔH 2、ΔH 3的关系正确的是
A.ΔH1=ΔH2=ΔH3 B.ΔH2<ΔH1<ΔH3
C.ΔH2<ΔH 3<ΔH1 D.ΔH2=ΔH3<ΔH1
2.在下列各说法中,正确的是
A.△H > 0 kJ·mol-1表示放热反应,△H < 0 kJ·mol-1表示吸热反应
B.热化学方程式中的化学计量数表示物质的量,可以是分数
C.1 mol H2SO4与1 molBa(OH)2反应生成BaSO4沉淀时放出的热叫做中和热
D.1 mol H2与0.5 molO2反应放出的热就是H2的燃烧热
1.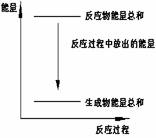 对于Zn(s)+H2SO4(l)==ZnSO4(l)+H2(g);ΔH
<0 的化学反应下列叙述不正确的是
对于Zn(s)+H2SO4(l)==ZnSO4(l)+H2(g);ΔH
<0 的化学反应下列叙述不正确的是
A.反应过程中能量关系可用右图表示
B.ΔH的值与反应方程式的计量系数有关
C.若将该反应设计成原电池锌为负极
D.若将其设计为原电池当有32.5g锌溶解时, 正极放出气体一定为11.2L
25、(1)5.8 5.4
(2)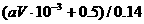
(3)57.8
24、I. 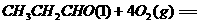
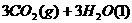 ;
;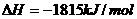
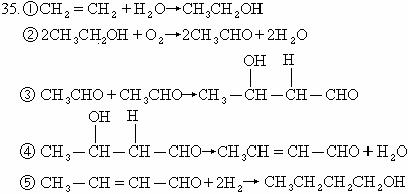 II. (1)86 氧化反应 羟基
II. (1)86 氧化反应 羟基
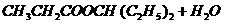 (2)
(2)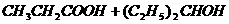

(3)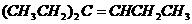 (4)3
(4)3
23、 (1)Cl2(或氯气),Fe(或铁),Fe(OH)3(或氢氧化铁) (2)Cl2+2OH-=ClO-+Cl-+H2O
22、(1)MgCl2•6H2O Mg(OH)Cl + HCl↑ + 5H2O↑
MgCl2•6H2O MgO + 2HCl↑ + 5H2O↑ 或 Mg(OH)Cl MgO + HCl↑
在干燥的HCl气流中,抑制了MgCl2水解,且带走MgCl2•6H2O受热产生的水气,故能得到无水MgCl2
(2)加入MgCl2溶液,充分搅拌,过滤,沉淀用水洗涤
(3)搅拌,加速溶解; 使待滤液体沿玻璃棒流入漏斗,防止外洒
搅拌,防止因局部过热液滴或晶体飞溅
21.BG
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com