
题目列表(包括答案和解析)
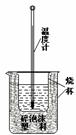
15.(10分)实验室利用如右图装置进行中和热的测定。回答下列问题:
(1) 图中有两处未画出,它们是 、 ;
(2) 果用0.5 mol/L的盐酸和氢氧化钠固体进行实验,则实验中所
测出的“中和热”将 (填“偏大”、“偏小”或“不变”);
原因是 ;
在操作正确的前提下提高中和热测定的准确性的关键是 ;
14.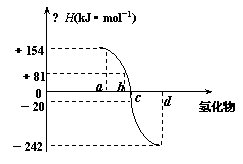 (8分)已知:在热力学标准态(298K、1.01×105Pa)下,由稳定的单质发生反应生成1mol化合物的反应热叫该化合物的生成热(△H)。右图为氧族元素氢化物a、b、c、d的生成热数据示意图。试回答下列问题:
(8分)已知:在热力学标准态(298K、1.01×105Pa)下,由稳定的单质发生反应生成1mol化合物的反应热叫该化合物的生成热(△H)。右图为氧族元素氢化物a、b、c、d的生成热数据示意图。试回答下列问题:
⑴ 出氧族元素中含有18e-的两种氢化
。
⑵ 你归纳:非金属元素氢化物的稳定性与氢化物的反应热△H的关系
。
 ⑶
硒化氢在热力学标准态下,发生分解反应的热化学反应方程式: 。
⑶
硒化氢在热力学标准态下,发生分解反应的热化学反应方程式: 。
13.(8分)称取等质量(均为ag)胆矾两份。把一份溶于bg水中,测知其溶解时吸收Q1kJ热量;把另一份脱水后溶于bg水中,测得其溶解时放热Q2kJ。 (1)胆矾的溶解热为______kJ·mol-1; (2)无水硫酸铜的溶解热为______kJ·mol-1; (3)从以上数据可知,胆矾脱水是______过程,1mol胆矾脱水需______kJ·mol-1热量。
12.(6分)已知下列两个热化学方程式;
H2(g)+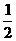 O2(g)===H2O(1); △H=-285.0kJ/mol;
O2(g)===H2O(1); △H=-285.0kJ/mol;
C3H8(g)+5O2(g)===3CO2(g)+4H2O(1); △H=-2220.0kJ/mol
(1)实验测得H2和C3H8的混合气体共5mol,完全燃烧生成液态水时放热6262.5kJ,则混合气体中H2和C3H8的体积比是 。
(2)已知:H2O(1)=H2O(g);△H=+44.0kJ/mol。写出丙烷燃烧生成CO2和气态水的热化学方程式:
11.(6分)已知下列热化学方程式的热效应:
(1)Fe2O3(s)+3CO(g)=2Fe(s)+3CO2(g);△H1=-26.7kJ·mol-1
(2)3Fe2O3(s)+CO(g)=2Fe3O4(s)+CO2(g);△H2=-50.75kJ·mol-1
(3)Fe3O4(s)+CO(g)=3FeO(s)十CO2(g);△H3=-36.5kJ·mol-1
计算下列反应的△H4:
FeO(s)+CO(g)=Fe(s)+CO2(g);△H4=
10.断裂一个给定的键时所消耗的能量称为离解能,提供下列烷烃的C-H键的离解能:
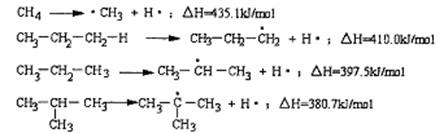
根据提供数据判断下列说法不正确的是
A.离解能愈小,C-H键易断裂,氢原子越易被取代
B.在光照条件下丙烷与氯气发生取代反应CH3CH2CH2Cl与CH3CHClCH3的物质的量之比为1:1
C.异丁烷与氯气发生取代反应,(CH3)3CCl占一氯代物的物质的量分数大于10%
D.C2H6中C-H的离解能介于410.0 kJ /mol~435.1kJ/mol
9.根据下表中列出的数据,判断下列热化学方程式书写不正确的是
|
化 学 键 |
H-H |
Cl-Cl |
H-Cl |
|
生成1mol化学键时放出的能量 |
436kJ·mol-1 |
243kJ·mol-1 |
431kJ·mol-1 |
A.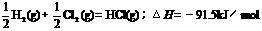
B.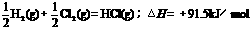
C.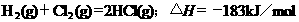
D.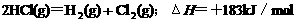
8.在一定条件下化学反应:2SO2(g)+O2(g) 2SO3(g);△H=-197 kJ/mol
现有容积相同的甲、乙、丙三个容器,在上述条件下分别充入的气体和反应放出的热量(Q)如下表所列:
2SO3(g);△H=-197 kJ/mol
现有容积相同的甲、乙、丙三个容器,在上述条件下分别充入的气体和反应放出的热量(Q)如下表所列:
|
容器 |
SO2 (mol) |
O2 (mol) |
N2 (mol) |
Q( kJ) |
|
甲 |
2 |
1 |
0 |
Q1 |
|
乙 |
1 |
0.5 |
0 |
Q2 |
|
丙 |
1 |
0.5 |
1 |
Q3 |
根据以上数据,下列叙述不正确的是
A.在上述条件下反应生成1 molSO3气体放热98.5 kJ
B.在上述条件下每摩该反应进行到底时放出的热量为197 kJ
C.Q1=2Q2=2Q3=197
D.2Q2=2Q3<Q1<197 kJ
7.下列关于反应能量的说法正确的是
A.Zn(s)+CuSO4(aq)=ZnSO4(aq)+Cu(s);△H = –216 kJ·mol-1,E反应物>E生成物
B.CaCO3(s)=CaO(s)+CO2(g);△H = +178.5 kJ·mol-1,E反应物>E生成物
C.HI(g) =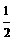 H2(g)+
H2(g)+
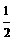 I2(s);△H = –26.5kJ·mol-1
I2(s);△H = –26.5kJ·mol-1
1mol HI在密闭容器中分解后放出26.5kJ的能量
D.H+(aq)+OH -(aq)=H2O(l);△H = –57.2 kJ·mol -1
含1molNaOH水溶液与含0.5mol H2SO4的浓硫酸混合后放热57.2 kJ
6.已知25℃、101kPa下,石墨、金刚石燃烧的热化学方程式分别为:
C(石墨)+O2(g)=CO2(g);ΔH= -393.51 kJ.mol-1
C(金刚石)+O2(g)=CO2(g);ΔH= -395.41 kJ.mol-1
据此推理所得到的下列结论正确的是
A.金刚石的燃烧热比石墨的燃烧热小
B.石墨晶体中碳碳键的强度小于金刚石中的碳碳键
C.等等质量石墨的能量比金刚石的能量高
D.由石墨制备金刚石一定是吸热反应
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com