
题目列表(包括答案和解析)
6.有A、B、C三种短周期的元素,A、B同周期,A、C的最低价离子分别为A2-和C-,B2+与C-具有相同的电子层结构。下列说法中正确的是
A.原子序数:A>B>C
B.原子半径:A>B>C
C.离子半径:A2->C->B2+
D.原子核外最外层电子数:A>C>B
5.拟晶(quasicrystal)是一种具有凸多面体规则外形但不同于晶体的固态物质。Al65Cu23Fe12是2000年之前发现的几百种拟晶之一,具有合金的某些优良物理性能。有关这种拟晶的说法错误的是
A.Al65Cu23Fe12的硬度比金属Al、Cu、Fe都大
B.Al65Cu23Fe12中三种金属的化合价均可视作零
C.Al65Cu23Fe12不可用作长期浸泡在海水中的材料
D.1mol Al65Cu23Fe12溶于过量的硝酸时共失去265 mol电子
4.下列说法正确的是
A.苯酚、淀粉KI、乙酸、氢氧化钾四种溶液可用FeCl3溶液一次鉴别
B.CH3CH2OH、 CH2=CHCOOH、 CH3CHO、 CH3COOH四种溶液可用新制Cu(OH)2一次鉴别
C.CaCl2溶液中混有少量HCl,可加入过量的CaO,再过滤
D.KCl溶液中混有少量KI,可通入足量Cl2后,再用乙醇进行萃取、分液
3.下列说法中正确的是
A.苯酚溶液不慎沾到皮肤上,应立即用稀NaOH溶液洗涤
B.液氯不能用钢瓶贮存
C.用饱和NaHCO3溶液可以除去CO2气体中混有的少量SO2
D.实验室中所有药品使用后均不能放回原瓶
2.下列说法无科学性错误的是
A.铅笔芯的原料是重金属铅,儿童在使用时不可用嘴吮咬铅笔,以免引起铅中毒
B.CO有毒,生有煤炉的居室,可放置数盆清水,这样可有效地吸收CO,防止煤气中毒
C.油条制作中常常加入明矾,不仅作为膨化剂,还有利于补充人体所需的微量元素
D.薯片、薯条等淀粉类油炸食品中丙烯酰氨(CH2=CHCONH2)含量较高,应谨慎食用
1.若甲、丙为短周期、同一主族元素组成的单质,乙、丁都是由两种元素组成的化合物,它们之间有如下图所示的转化关系,则满足条件的甲和丙可以为
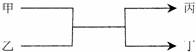
A.钠和氢气 B.氟和氧气
C.碳和硅 D.氯气和溴
13.空气中的SO2含量和可吸入颗粒的含量(可用g/cm3表示)都是重要的空气质量指标。在工业生产上规定:空气中二氧化硫的最大允许排放浓度不得超过0.02mg/L。
⑴为测定某地方的空气中SO2和可吸入颗粒的含量,甲同学设计了如下图所示的实验装置:
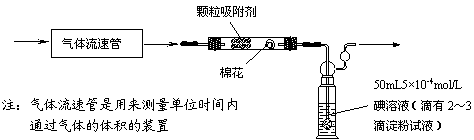
①应用上述装置测定空气中的SO2含量和可吸入颗粒的含量,除测定气体流速(单位:cm3/min)外,还需要测定 。
②已知:碘单质微溶于水,KI可以增大碘在水中的溶解度。
请你协助甲同学完成100mL5×10-4mol/L碘溶液的配制:
第一步:准确称取1.27g碘单质加入烧杯中, ;
第二步: ;
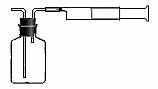 第三步:从第二步所得溶液中,取出10.00mL溶液于100mL容量瓶中,加水稀释至刻度线。
第三步:从第二步所得溶液中,取出10.00mL溶液于100mL容量瓶中,加水稀释至刻度线。
⑵乙同学拟用下列简易装置测定空气中的SO2含量:准确移取50mL5×10-4mol/L的碘溶液,注入右图所示广口瓶中,加2-3滴淀粉指示剂,此时溶液呈蓝色。在指定的测定地点抽气,每次抽气100mL,直到溶液的蓝色全部褪尽为止,记录抽气次数(n)。
①假设乙同学的测量是准确的,乙同学抽气的次数至少为 次,方可说明该地空气中的SO2含量符合排放标准。
②如果乙同学用该方法测量空气中SO2的含量时,所测得的数值比实际含量低,请你对其可能的原因(假设溶液配制、称量或量取及各种读数均无错误)提出合理假设:
_________________________________________________________________________________________________________________________________________________________。
③丙同学认为:乙同学的实验方案需要抽气的次数太多,操作麻烦。与乙讨论后,决定将抽气次数降到100次以下,请你设计合理的改进方案:
。
⑶改变合适的吸收液,乙同学使用的装置还可以测定新装修的居室空气中甲醛的浓度,吸收剂最好选用 (选填:①浓硫酸、②银氨溶液、③新制的氢氧化铜、④酸化的高锰酸钾溶液)。
12.(某地有软锰矿(主要成份为MnO2,含少量Al2O3、SiO2)和闪锌矿(主要成份ZnS,含少量FeS、CuS、CdS、SiO2),科研人员采用新工艺生产二氧化锰和锌,同时还得副产品镉和X、Y、Z等。工业流程图如下图(框图中水省略):
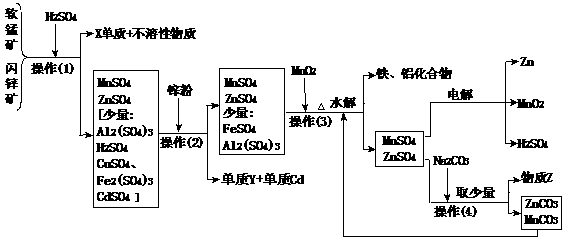
请回答:
(1)副产品X的名称是 ,Y的名称是 、Z的化学式为 。
(2)他们的主要产品中的元素在周期表中,锌属 族,X在 周期。
(3)图中“操作(1)~(4)”都包含的共同一种操作,在实验室中该操作的名称为 。
(4)操作(1)中,在稀H2SO4存在下MnO2把硫化物氧化成硫单质和+2价硫酸盐。如果硫化物用MS表示,请写出MnO2与硫化物反应的化学方程式: 。
(5)操作(3)生成的铁、铝化合物的化学式为 。
(6)请写出电解制得锌和二氧化锰的化学方程式 。
(7)旧工艺生产二氧化锰,是将软锰矿与煤混合粉碎后高温焙烧,再用硫酸浸取焙烧料净化后电解。对比旧工艺,新工艺有好多个优点,请你至少说出新工艺的一个优点:
。
11.证明KClO3中含有K、Cl、O三种元素的实验步骤及每一步的实验目的是
① ;
② ;
③ ;
④ 。
10.铜的冶炼大致可分为:⑴富集,将硫化物矿进行浮选;
⑵焙烧,主要反应为:2CuFeS2+4O2==Cu2S+3SO2+2FeO(炉渣);
⑶制粗铜,在1200℃发生的主要反应为:2Cu2S+3O2 ==2Cu2O+2SO2;
2Cu2O+ Cu2S=6 Cu+SO2↑; ⑷电解精炼。
下列说法正确的是
A.上述灼烧过程的尾气均可直接排空
B.由6mol CuFeS2生成6molCu,上述共消耗15molO2
C.在反应2Cu2O+ Cu2S==6Cu+SO2↑中,作氧化剂的只有Cu2O
D.电解精炼时,粗铜应与外电源正极相连
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com