
题目列表(包括答案和解析)
26.(4分)在537℃、1.01×105 Pa和催化剂存在的条件下,向某密闭容器中充入1 mol SO2和0.5molO2,此时体积为100 L,在温度和压强不变条件下反应达到平衡时,SO3体积分数为0.91。若保持温度和压强不变,充入1 mol SO3,则平衡时SO2体积分数为______ ;若保持温度和体积不变,充入a mol SO2和b mol O2,且a∶b=2∶1,反应达到平衡时SO3体积分数仍为0.91,则a =_____ _ 。
24、(10分)A、B、C是三种常见的短周期元素,它们的原子序数依次增大,B元素原子最外层电子数是C元素原子最外层电子数的一半,A元素最外层电子数比B多一个。甲、乙、丙是3种含氧酸的钠盐,甲中含B元素,乙中含C元素,丙中含A元素,甲、丙溶液PH>7;乙溶液PH<7;丁为气体,戊为淡黄色固体。甲、乙、丙、丁、戊、己六种物质之间的相互反应关系如下图:
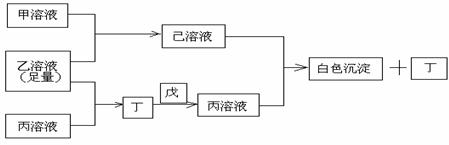
请回答:
(1)写出C元素的原子结构示意图______,写出丁和戊的电子式_______、______;
(2)用有关化学用语(离子方程式与必要文字说明)解释:
乙溶液呈酸性的原因 ____________________________
丙溶液呈碱性的原因____________________________
(3)写出有关反应的离子方程式:
①乙溶液+丙溶液→丁______________________________ ;
②己溶液+丙溶液→丁______________________________ 。
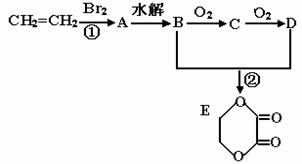 25.(8分)由乙烯和其它无机原料合成环状 化合物其合成过程如下(水及其它无机产物均已省略):
25.(8分)由乙烯和其它无机原料合成环状 化合物其合成过程如下(水及其它无机产物均已省略):
请分析后回答下列问题:
(1)D物质中的官能团为__________________________;
(2)反应的类型分别是①_____________、②________________;
(3)C物质的结构简式_________________,物质X与A互为同分异构体,则X的结构简式为______________________,X的名称为_________________;
(4)反应②的化学方程式(注明反应条件)_______________________________
23、(6分)A、B、C、D均为常见的短周期元素,常温下A、B可形成两种常见的液态化合物,其最简式分别为BA和B2A,B与D可形成分子X,也可形成阳离子Y,
X和Y在水溶液中酸碱性正好相反,C+的焰色反应呈黄色。
(1)C元素在周期表中的位置是 ,液态X类似B2A也能微弱电离产生电子数相同的两种离子,则液态X的电离方程式:
(2)M、N是由A、B、C、D四种元素中任意三种元素组成的不同类型的强电解质,M的水溶液呈碱性,N的水溶液呈酸性,且M溶液中水的电离程度小于N溶液中水的电离程度。则M、N分别为 (填化学式)若将0.1mol/L M和0.2mol/L N两溶液等体积混合所得溶液中离子浓度的大小顺序为
22.(7分)某研究性学习小组对过量炭粉与氧化铁反应的气体产物成分进行研究。
(1)提出假设:该反应的气体产物全部是二氧化碳。
(2)设计方案:如图所示,将一定量的氧化铁在隔绝空气的条件下与过量炭粉完全反应,测定参加反应的碳元素与氧元素的质量比。
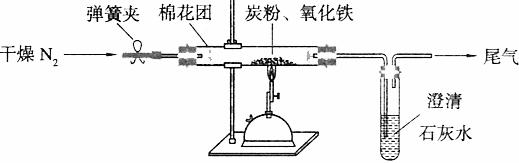
(3)查阅资料:氮气不与碳、氧化铁发生反应。实验室可以用氯化铵饱和溶液和亚硝酸钠(NaNO2)饱和溶液混合加热反应制得氮气。请写出该反应的离子方程式: 。
(4)实验操作及实验现象:
①按上图连接装置,并检查装置的气密性,称取3.20g氧化铁与2.00g炭粉混合均匀,放入48.48g的硬质玻璃管中;
②加热前,先通一段时间纯净干燥的氮气;
③停止通入N2后,夹紧弹簧夹,加热一段时间,澄清石灰水变浑浊;
④待反应结束,再通一段时间的氮气。冷却至室温,称得硬质玻璃管和固体总质量为52.24g。
(5)数据处理,经计算,参加反应的碳元素质量为0.48g氧元素为0.96g。得出原假设不成立,理由是
。
(6)得出结论:根据数据处理结果判断反应产生的气体是 ,
该实验中发生的化学方程式为 。
(7)实验优化:根据实验得出的结论,应对该实验装置进一步完善,你认为应作如何改进? 。
21.(8分)某教科书对“铝热反应”实验的现象有这样的描述:“反应放出大量的热,并发出耀眼的白光”,“纸漏斗的下部被烧穿,有熔融物落入沙中”。
已知:Al、Fe的熔点、沸点数据如下:
|
物质 |
Al |
Fe |
|
熔点(℃) |
660 |
1535 |
|
沸点(℃) |
2467 |
2750 |
(1)某同学猜测,铝热反应所得到的熔融物是铁铝合金。理由是:该反应放出大量的热能使铁熔化,而铝的熔点比铁低,所以铁和铝能形成合金。你认为他的解释是否合理? (填“合理”或“不合理”)。
(2)根据你所掌握的知识找出一种验证产物中有单质Fe的最简单方法:
。
(3)设计一个实验方案,证明上述所得的熔融物中含有金属铝。填写下列表格:
|
所用试剂 |
|
|
实验操作及现象 |
|
|
有关反应的化学方程式 |
|
20.(4分)根据观有中学化学知识,判断下面实验设计或操作可以实现实验目的的是(填序号)
A. 做中和热测定实验时,若没有环形玻璃搅拌棒,可用环形铜质搅拌棒代替
B. 实验室制备乙烯时必须将温度计水银球插入反应液中,测定反应液温度
C. 取少量蔗糖溶液加稀硫酸水浴加热几分钟后加新制的氢氧化铜浊液加热,观察现象,判断蔗糖水解的产物中是否含有葡萄糖
D. 在苯中加入溴水充分振荡、静置,观察现象,判断苯环中是否存在碳碳双键
E. 实验室制备乙酸乙酯时,先将乙醇、乙酸混合,再把混合液加入到浓硫酸中
F. 实验室制备乙酸乙酯时,吸收液为饱和碳酸钠溶液而不用饱和碳酸氢钠溶液
G. 除去蛋白质溶液中少量的NaCl,可将装有混合液的半透膜袋放入流水中渗析
H. 用冰醋酸、蒸馏水和100mL容量瓶等仪器配制100mLpH为1的醋酸稀溶液
I. 中和滴定时,酸式滴定管用蒸馏水清洗几次后,即加入标准盐酸进行滴定
J.实验室用洁净的试管做银镜反应时不能将试管直接放在酒精灯火焰上加热
19.为确定某溶液的离子组成,进行如下实验:①测定溶液的pH,溶液显强碱性。
②取少量溶液加入稀盐酸至溶液呈酸性,产生无刺激性、使澄清石灰水变浑浊的气体。
③在上述溶液中再滴加Ba(NO3)2溶液,产生白色沉淀。
④取上层清液继续滴加Ba(NO3)2溶液至无沉淀时,再滴AgNO3溶液,产生白色沉淀。
根据实验以下推测正确的是
A.一定有SO32-离子 B.一定有CO32-离子存在
C.一定有C1-离子存在 D.不能确定HCO3-离子是否存在
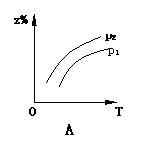
18.已知反应X(g)+3Y(g) 2Z(g);△H<0,z在不同温度、不同压强(p1>p2)下达到平衡时,混合气体中Z的百分含量z%随温度和压强变化的曲线应为 ( )
2Z(g);△H<0,z在不同温度、不同压强(p1>p2)下达到平衡时,混合气体中Z的百分含量z%随温度和压强变化的曲线应为 ( )

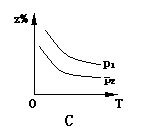
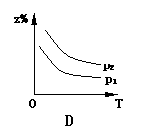
16.下列反应的离子方程式正确的是
A.次氯酸钙溶液中通入过量CO2:Ca2+ +2ClO-+CO2+H2O=CaCO3↓+2HClO
B.石灰石溶于醋酸:CaCO3+2H+=Ca2++CO2↑+H2O
C. Ca(HCO3)2与过量NaOH溶液反应:Ca2++2HCO3-+2OH-=CaCO3↓+CO32-+2H2O
D.氯气与水反应C12+H2O=2H++Cl-+ClO-
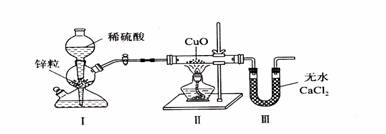 17.用下图装置测定水中氢、氧元素的质量比,其方法是分别测定通氢气前后玻璃管的质量差和U型管的质量差。某同学通过实验得出的结论是m(H):m(O)>1:8。下列对导致这一结果原因的分析中,一定不合理的是( )
17.用下图装置测定水中氢、氧元素的质量比,其方法是分别测定通氢气前后玻璃管的质量差和U型管的质量差。某同学通过实验得出的结论是m(H):m(O)>1:8。下列对导致这一结果原因的分析中,一定不合理的是( )
A.CuO没有全部被还原 B.Ⅲ装置后缺少干燥装置
C.Ⅱ装置中的CuO粉末可能不干燥 D.Ⅰ、Ⅱ装置之间缺少干燥装置
15.已知胆矾溶于水时温度降低,室温下将1mol无水硫酸铜配成溶液时放出的热量为Q1kJ,又知胆矾分解的热化学方程式为∶
CuSO4•5H2O(s)=CuSO4(s) + 5H2O(l) ΔH= +Q2kJ/mol 则Q1、Q2的关系为
A. Q1<Q2 B. Q1>Q2 C. Q1=Q2 D. 无法确定
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com