
题目列表(包括答案和解析)
4.常温下,浓度为0.1 mol/L的一元酸HA溶液的pH=2.0,浓度为0.1 mol/L的一元碱BOH溶液中c(H+):c(OH-)=1.0×10-12。将此两种溶液等体积混合后,所得溶液中离子浓度大小关系正确的是( )
A.c(OH-)>c(H+)>c(B+)>c(A-) B.c(B+)>c(A-)>c(H+)>c(OH-)
C.c(B+)>c(A-)>c(OH-)>c(H+) D.c(B+)>c(A-)>c(H+)>c(OH-)
3.氯化硼的熔点为-107℃,沸点为12.5℃,在其分子中键与键之间的夹角为120o,它能水解,有关叙述不正确的是( )
A.氯化硼液态时能导电而固态时不导电 B.氯化硼加到水中使溶液的pH降低
C.氯化硼分子呈正三角形,属非极性分子 D.氯化硼遇水蒸气会产生白雾
2.最近的病毒学家研究发现,一氧化氮对“非典”病毒的抑制作用明显。下列关于NO的说法正确的是( )
A.NO是亚硝酸酐 B.NO只能通过人工合成
C.NO可以是某些含低价态氮元素的物质的氧化产物
D.NO与O2按4∶1体积比混合后与足量的水反应可完全转化为硝酸
1.我国科学家在世界上第一次为一种名为“钴酞菁”的分子(直径为1.3×10-9m)恢复了磁性。“钴酞菁”分子结构和性质与人体内的血红素及植物体内的叶绿素非常相似。下列说法不正确的是( )
A.“钴酞菁”分子所形成的分散系具有丁达尔效应
B.“钴酞菁”分子既能透过滤纸,也能透过半透膜
C. 此项工作可以用来改变分子的某些物理性质
D. 此工作可广泛应用于光电器件、生物技术等方面
25.(6分)向由Cu、Cu2O和CuO组成的混合物中,加入10mL6mol·L-1的稀硝酸溶液,恰好使混合物完全溶解,同时收集到标准状况下NO 224 mL。请回答以下问题:
(1)产物中硝酸铜的物质的量为
(2)若原混合物中有0.01molCu,则其中Cu2O的物质的量为
CuO的物质的量为 .
24.(5分)在一定温度下,向一个容积不变的容器中,加入3molSO2和2molO2 及固体催化剂,使之发生反应: 2SO2(g)
+ O2 (g)  2SO3 (g)
△H=-196.6kJ/mol 平衡时容器内气体压强为起始时的90%。此时
2SO3 (g)
△H=-196.6kJ/mol 平衡时容器内气体压强为起始时的90%。此时
Ⅰ、加入3molSO2和2molO2 发生反应,达到平衡时,放出的热量为 。
Ⅱ、保持同一反应温度,在相同的容器中,将起始物质的量改为amolSO2、bmolO2、cmolSO3(g),欲使平衡时SO3的体积分数为2/9 ,
①达到平衡时,Ⅰ与Ⅱ放出的热量 (填序号)。
A.一定相等 B.前者一定小 C.前者大于或等于后者 D.前者小于或等于后者
②a、b、c必须满足的关系是(一个用a、c表示,另一个用b、c表示) 、 。
③欲使起始时反应表现为向正反应方向进行,a的取值范围是: 。
23.(7分) 850℃时反应A(g)+B(g) C(g)+D(g) ΔH<0,K=l。t℃时,在一定体积的容器中,通入一定量的A和B发生化学反应,各物质浓度随时间变化如下表:
C(g)+D(g) ΔH<0,K=l。t℃时,在一定体积的容器中,通入一定量的A和B发生化学反应,各物质浓度随时间变化如下表:
t℃时物质的浓度(mol·L-1)变化
|
时间/min |
A |
B |
C |
D |
|
0 |
0.200 |
0.300 |
0 |
0 |
|
2 |
0.138 |
0.238 |
0.062 |
0.062 |
|
3 |
0.100 |
0.200 |
0.100 |
0.100 |
|
4 |
0.100 |
0.200 |
0.100 |
0.100 |
|
5 |
0.116 |
0.216 |
0.084 |
|
|
6 |
0.096 |
0.266 |
0.104 |
|
(1)计算t℃该化学反应的平衡常数:
(2)t℃ 850℃(填大于、小于或等于)。判断依据是
(3)反应在4min-5min之间,平衡 (填“向左”、“向右”或“不”)移动,可能的原因是
a.增加A的浓度 b.增加D的浓度 c.加压 d.使用催化剂
(4)某温度下反应C(g)+D(g)  A(g)+B(g)的平衡浓度符合c(C)·c(D)=2c(A)·c(B),则此时的温度
8500C(填大于、小于或等于)
A(g)+B(g)的平衡浓度符合c(C)·c(D)=2c(A)·c(B),则此时的温度
8500C(填大于、小于或等于)
22.(8分)下列框图所示反应有直接进行的,也有在溶液中进行的,其中部分产物已略去。已知:A是固体单质,Y是一种无色液体,既可作氧化剂,又可作还原剂,B、X、秒为气体单质,D属于可溶于水的强电解质,一个D分子含有18个电子。

(1)化学式:B为 ,F为 。
(2)写出反应①和②的化学方程式
。
(3)用离子方程式表示E物质能用于净水的原理
21.(8分)现有第二、三周期元素性质的部分数据,其中X数值表示不同元素的原子吸引电子的能力大小,若X值越大,元素的非金属性越强,金属性越弱。X值相对较大的元素在所形成的分子中化合价为负价:
|
编号 |
① |
② |
③ |
④ |
⑤ |
⑥ |
⑦ |
⑧ |
⑨ |
|
|
X |
3.44 |
2.55 |
0.98 |
2.04 |
2.19 |
3.16 |
0.93 |
3.04 |
1.61 |
|
|
常见化合价 |
最高价 |
|
+4 |
+1 |
+3 |
|
|
+1 |
|
+3 |
|
最低价 |
-2 |
|
|
|
-3 |
-1 |
|
-3 |
|
(1)画出元素⑥的离子结构示意图
(2)元素⑦和元素⑨的氢氧化物反应的离子方程式为
(3)“神舟五号”飞船内采用一种化合物来吸收航天员呼出的CO:,你认为该物质
应该是由上表中的 (填序号)元素组成的,用电子式表示仅由以上元素形成另外一种化合物的过程
(4)将8g元素②的单质在足量的元素①的单质中燃烧,所得气体通入1Llm01·L-1。
的NaOH溶液中,完全吸收后,溶液中离子浓度由大到小的顺序
20.(13分)某课外活动小组利用以下装置探究氯气与氨气之间的反应。其中 A 、F 分别为氨气和氯气的发生装置,C为纯净的氯气于氨气反应的装置。
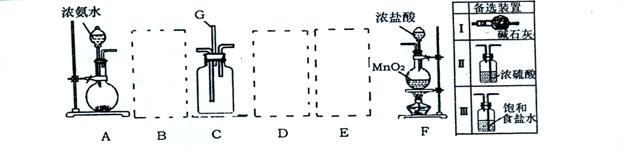
请回答下列问题:
(1)装置F中发生反应的离子方程式 。
(2)装置A中烧瓶内固体可以选用 (选填以下选项的代号)。
A.碱石灰 B.生石灰 C.二氧化硅
D.五氧化二磷 E.烧碱 F.氢氧化钠和氯化铵的混合物
(3)上图A-F是按正确实验装置顺序排列的。虚线框内应添加必要的除杂装置,
请从上图的备选装置中选择,并将编号填人下列空格:B
D ,E
(4)氯气和氨气在常温下混合就会反应生成氯化铵和氮气,写出反应的化学方程式
。装置C内出现浓厚的白烟并在容器内壁凝结,请设计一个实验方案检验其中的NH4+
(5)若从装置C的G处逸出的尾气只含有N2和少量Cl2,应如何处理才能不污染
环境?
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com