
题目列表(包括答案和解析)
21.(12分)下面是A、B、C、D、E、F、G、H 8种元素在周期表的位置。

据此回答下列问题:
(1)金属性最强的是(填元素符号): ;属于过渡元素的是(填元素符号): 。
(2)A、C两元素形成的化合物中含有非极性键的是(写分子式): ;
D、C两元素按原子个数比 1:1 形成的化合物属于 化合物,
其电子式为: 。
(3)在上述元素中由两种元素形成的化合物中,属于非极性分子的是(只写出两种) 、 。
(4)A分别与B、C、E、F形成的四种化合物的固态都属于 (填写“离子晶体、原子晶体或分子晶体”),其晶体中有氢键的是 。(写分子式)
(5)由A、C形成的一种化合物与C、E形成的一种化合物可以发生氧化还原反应,生成一种强酸,请写出化学反应方程式:
。
若该反应中有0.5mol的强酸生成时,则反应中被还原的氧化剂质量是 g。
20.用干燥的高锰酸钾可以制得极纯而干燥的氧气:KMnO4→MnO2+K2O+O2(240℃)。下列说法不正确的是[ ]
A.每生成11.2 L氧气转移了2 mol电子
B.相同质量的KMnO4分解,上述生成MnO2的反应比生成K2MnO4的反应放出更多氧气
C.O2是氧化产物,MnO2是还原产物
D.在此条件下,KMnO4的氧化性强于O2

 高三12月月考
高三12月月考
化 学 试 卷
第Ⅱ卷(非选择题 共60分)
19.一种新型燃料电池,它以多孔镍板为电极插入KOH溶液中,然后分别向两极上通甲烷和氧气,其电极反应式为:CH4+10OH--8e-=CO32-+4H2O
4H2O+2O2+8e-====8OH-有关此电池的推断正确的是 [ ]
A.通甲烷的电极为负极
B.溶液pH将增大
C.放电一段时间后,KOH的物质的量浓度不变
..... D.参加反应的O2和CH4的物质的量比为4:1
18.根据相关化学原理,下列判断正确的是[ ]
A.若X是原子晶体,Y是分子晶体,则熔点:X<Y
B.若A2+2D-→2A-+D2,则氧化性:D2>A2
C.若R2-和M+ 的电子层结构相同,则原子序数:R>M
D.若弱酸HA的酸性强于弱酸HB,则同浓度钠盐溶液的碱性:NaA<NaB
17、为证明某可溶性一元酸(HX)是弱酸,同学们设计了如下实验方案。其中不合理的是[ ]
A.室温下,测0.1mol/L HX溶液的pH ,若pH>1,证明HX是弱酸
B.室温下,测1mol/L NaX溶液的pH ,若pH>7,证明HX是弱酸
C.将等浓度、等体积的HCl和NaX溶液混合,若混合溶液pH<7,证明HX是弱酸
D.在相同条件下,对0.1 mol/L的HCl和0.1mol/L的HX进行导电性实验,若HX溶液灯泡较暗,证明HX为弱酸
16.在容积不变的密闭容器中存在如下反应:2SO2(g)+O2(g)
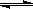 2SO3(g);△H<0
2SO3(g);△H<0
某研究小组研究了其他条件不变时,改变某一条件对上述反应的影响,下列分析正确的是[ ]
A.图I研究的是t0时刻增大O2的浓度对反应速率的影响
B.图II研究的是t0时刻加入催化剂后对反应速率的影响
C.图III研究的是催化剂对平衡的影响,且甲的催化效率比乙高
 D.图III研究的是温度对化学平衡的影响,且甲的温度较高
D.图III研究的是温度对化学平衡的影响,且甲的温度较高
15.水溶液中的Xn+、Ym+、Zn-三种离子,已知m>n,且X、Y、Z三种原子的M层电子数均为奇数。下列说法中不正确的是[ ]
A.三种元素的最高正价氧化物的相应水化物之间能两两反应
B.Ym+离子的半径最小
C.Y元素一定是金属元素
D.原子半径Z>X>Y
14.t℃时向100g氢氧化钠的饱和溶液中加入6.2g氧化钠,充分反应后恢复至t℃, 下列叙述正确的是[ ]
A.析出固体物质的质量大于8g B.溶液的pH变大
C.所得溶液的质量为98.2g D.溶液中Na+ 浓度变大
13.将pH=2的醋酸和pH=12的NaOH溶液等体积混合,所得溶液中离子浓度关系正确的是[ ]
A.c(CH3COO-)>c(Na+)>c(H+) >c(OH-)
B.c(Na+)>c(CH3COO-)>c(H+)>c(OH-)
C.c(CH3COO-)>c(Na+)>c(OH-)>c(H+)
D.c(Na+)>c(CH3COO-)>c(OH-)>c(H+)
12.下列离子方程式书写正确的是[ ]
A.明矾溶液与氢氧化钡溶液反应,使SO42-恰好完全沉淀:
Al3++2SO42-+2Ba2++3OH-====2BaSO4↓+Al(OH)3↓
B.向FeBr2溶液中通入过量氯气:
2 Fe2+ + Cl2
 2Fe3+
+ 2Cl-
2Fe3+
+ 2Cl-
C.用铂电极电解MgCl2溶液时发生的反应:
2Cl-+2H2O Cl2↑+H2↑+2OH-
Cl2↑+H2↑+2OH-
D.常温下将硝酸铵溶液与KOH溶液混合: NH4++OH-====NH3·H2O
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com