
题目列表(包括答案和解析)
17.(13分)
①500mL容量瓶、玻璃棒、胶头滴管
②13.6mL; >
 ③在250mL烧杯中先加入适量蒸馏水,再将量取的浓硫酸沿烧杯内壁慢慢倒入烧杯中,并用玻璃棒不断搅拌
③在250mL烧杯中先加入适量蒸馏水,再将量取的浓硫酸沿烧杯内壁慢慢倒入烧杯中,并用玻璃棒不断搅拌
④ACF
24.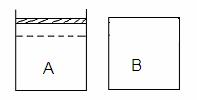 (10分)如右下图所示两个等体积的容器,A为恒压容器,B为恒容容器。在相同温度下,分别将1 mol N2 和3 mol H2 混合气体充入A、B容器中,发生如下反应:
(10分)如右下图所示两个等体积的容器,A为恒压容器,B为恒容容器。在相同温度下,分别将1 mol N2 和3 mol H2 混合气体充入A、B容器中,发生如下反应:
 N2(g)+3 H2
(g) 2NH3
(g); △H=-92.4 kJ/mol 。
N2(g)+3 H2
(g) 2NH3
(g); △H=-92.4 kJ/mol 。
保持温度不变,A、B容器中的反应均达到平衡状态。平衡时,A容器中气体体积为起始时的4/5,平衡状态记为P。
试回答下列问题:
(1) 平衡时A容器中NH3 的体积分数是 。若要使B容器中NH3 的体积分数与 A容器中相同,可采取的措施是 。
(2) 若保持温度不变,向B容器中补加c mol NH3 ,再次达到平衡时,A、B两容器中压强恰好相等,则c= 。
(3)若保持温度不变,开始时向容器A中加入a mol N2 、b mol H2和c mol NH3 ,要使反应向逆反应方向进行,且达到平衡后各气体的物质的量与原A平衡状态P相同,则起始时,c的取值范围是 。
(4)若保持温度不变,开始时向容器B中加入a mol N2 、b mol H2 和 1 mol NH3 ,平衡时,测得放出的热量为23.1 kJ,NH3 的体积分数与A容器平衡状态P相同,则a + b 的值是 。
高三化学第十七周周周练试题
|
题目 |
1 |
2 |
3 |
4 |
5 |
6 |
7 |
8 |
9 |
10 |
|
答案 |
C |
D |
B |
C |
C |
B |
C |
A |
AC |
B |
|
题目 |
11 |
12 |
13 |
14 |
15 |
16 |
|
|
|
|
|
答案 |
D |
BD |
B |
A |
B |
D |
|
|
|
|
23.(8分) 发射航天飞机的火箭常用氮的氢化物肼(N2H4)作燃料。试回答下列有关问题:
⑴在结构上N2H4和NH3的关系有如H2O2和H2O的关系。N2H4能发生下列反应:

 N2H4 + H3O+
N2H5+
+ H2O
N2H4 + H2O N2H5+ + OH-
N2H4 + H3O+
N2H5+
+ H2O
N2H4 + H2O N2H5+ + OH-

 N2H5+
+ H2O N2H62+ + OH- N2H5+
+ H2O N2H4 + H3O+
N2H5+
+ H2O N2H62+ + OH- N2H5+
+ H2O N2H4 + H3O+
据此你可得出的结论是 (填字母)。
A.肼水解显酸性 B.肼在水中电离出H+
C.肼是二元弱碱 D.肼是二元弱酸
⑵ 液态NH3类似H2O,也能微弱电离且产生电子数相同的两种离子,则液态NH3电离方程式为 。
⑶ 25℃时,0.2 mol·L-1 氨水与0.2 mol·L-1HCl 溶液等体积混合(忽略混合后溶液体积的变化),测得混合溶液的pH=a(a<7)。则混合溶液中由水电离出的c(H+) (填“大于”、“等于”或“小于”) 0.2 mol·L-1HCl 溶液中电离出的c(H+);混合溶液中,c(H+)-c(NH3·H2O)= (用含有a的关系式表示)。
22.(12分) 在人类社会的发展进程中,金属起着重要的作用。铝是国民经济发展的重要材料,目前我国铝消费超过430万吨,在众多的金属中仅次于钢铁。
经查阅,铝及其氧化物的有关实验数据如下:
|
|
熔点/℃ |
沸点/℃ |
燃烧热/kJ·mol-1 |
|
铝 |
660 |
2467 |
602 |
|
氧化铝 |
2050 |
2980 |
/ |
(1) 铝是地壳中含量最多的金属元素,它占地壳总质量的7.51%,比铁几乎多1倍,是铜的近千倍。但人类发现和利用铝比较迟,你认为其主要原因是 。
(2) 用坩埚夹住一小块铝箔(箔厚约0.1mm),在酒精灯上加热至熔化,轻轻晃动,观察到的现象是:铝箔熔化,失去了光泽,熔化的铝并不滴落,好像有一层膜兜着。铝箔“卷缩不脱落”是因为 。
(3)将铝片插入硝酸汞溶液中,铝片表面灰暗,用湿布擦试后,铝片上附着了液态银白色的物质。将该铝片静置一段时间,铝片表面长出白色须状物,手持铝片时,白色须状物脱落,铝片发烫。经实验白色须状物能溶于稀盐酸且无气体放出。试写出直接导致铝片发烫的热化学反应方程式 。
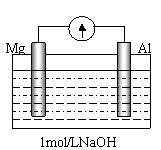 (4) 剪取大小、表面积相近的镁条和铝片,用砂纸打磨其表面,使镁条与铝片与电流计相连接后迅速插入盛有1mol/LNaOH溶液的烧杯中(如图)。预期的实验现象是:铝片溶解,镁片上有大量气泡放出。然而实验事实是:开始,铝片表面有许多气泡,随后,铝片表面气泡减少,镁条表面只有少量气泡产生,电流计显示电流方向与开始时相反。请写出后一过程镁片上的电极反应式
。
(4) 剪取大小、表面积相近的镁条和铝片,用砂纸打磨其表面,使镁条与铝片与电流计相连接后迅速插入盛有1mol/LNaOH溶液的烧杯中(如图)。预期的实验现象是:铝片溶解,镁片上有大量气泡放出。然而实验事实是:开始,铝片表面有许多气泡,随后,铝片表面气泡减少,镁条表面只有少量气泡产生,电流计显示电流方向与开始时相反。请写出后一过程镁片上的电极反应式
。
(5) 能源问题是人们关心的热点,有人提出用金属铝作燃料,这真是一种大胆而新颖的设想。对此,你的观点是 (填“A”或“B”) A.可行 B.不可行,其理由是 。
21.(13分)下图中A~J分别代表有关反应中的一种物质,它们均为中学化学中的常见物质。已知A~E和F~J中分别含有同一种元素。反应E→A+O2的条件未标出。
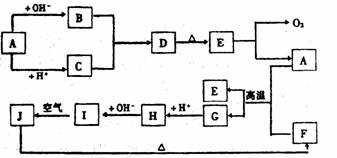
请填写下列空白:
(1)化合物H中的阳离子是 ;D的化学式为 。
(2)A生成B反应的离子方程式是 。
(3)A和F的混合物叫做 ,发生反应的化学方程式是 。
(4)写出B与C生成D的离子方程式 。
(5)I→J反应的化学方程式是 ;该反应过程中发生的现象是 。
20.(11分)A、B、C、D均为短周期元素,A、B可形成两种液态化合物,其最简式分别为BA和B2A;A与D可形成气态化合物DA和DA2;A、B、D可组成离子晶体,该晶体的化学式为B4A3D2,其水溶液呈现弱酸性;B与D可组成一种极易溶于水的碱性气体X,B与C可形成极易溶于水的酸性气体Y。已知X分子与B2A分子中的电子数相等,Y分子中的电子数与最简式为BA的液态化合物的电子数相等。请回答:
(1)写出四种元素的符号:A ,B ,C ,D ;
(2)B4A3D2的化学式为: ,其水溶液显酸性的离子方程式为: ;
(3)已知液态X和B2A相似,也可发生微弱的电离,电离出含有相同电子数的微粒,则X的电离方程式为: ;
(4)已知Na与X反应和Na与B2A相似,写出Na与X反应的化学方程式:
。
19.(7分)在淀粉KI溶液中滴入少量NaClO溶液,并加入少量硫酸,溶液立即变为蓝色,其反应的离子方程式为 。在上述蓝色溶液中滴入足量的Na2SO3溶液,蓝色立即消失,其反应的离子方程式为 ,从以上实验可知,ClO-、I2、SO42-的氧化性由强到弱的顺序是 。
18、(12分)某研究小组进行与NH3有关的系列实验。
(1) 从下图中挑选所需仪器,画出制取干燥NH3的装置简图(添加必要的塞子、玻璃导管、胶皮管。固定装置和尾气处理装置不用画),并标明所用试剂。


(2)将NH3通入溴水中,有N2生成,反应的化学方程式为 。
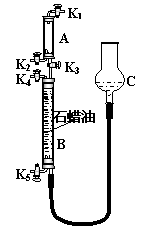 (3)为验证“同温同压下,相同体积的任何气体都含有相同数目的分子”,该小组同学设计了如第6页右上图所示的装置,图中B管的容积是A管的2倍,活塞K1、K2、K3、K4、K5均关闭(固定装置和尾气处理装置略);HCl和NH3均不溶于石蜡油,也不与之反应;装置气密性好。
(3)为验证“同温同压下,相同体积的任何气体都含有相同数目的分子”,该小组同学设计了如第6页右上图所示的装置,图中B管的容积是A管的2倍,活塞K1、K2、K3、K4、K5均关闭(固定装置和尾气处理装置略);HCl和NH3均不溶于石蜡油,也不与之反应;装置气密性好。
①在A管中充满与大气压强相等的干燥HCl气体。操作是
。
控制活塞K4、K5,调节C,使B管充满与A管同压的干
燥NH3。
②缓缓开启K3,A管中的现象是 。
要达到实验目的,当反应完成并恢复到室温时,B管中预
期的现象是 ;
若观察不到预期现象,主要原因是 。
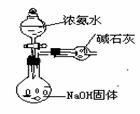
17. (13分)右图是某学校实验室从化学试剂商店买回的硫酸试剂标签上的部分内容。某次学生实验需要0.5mol/LH2SO4溶液480ml,若由你来配制所需溶液,请根据实验室已有的仪器和药品情况回答下列问题:
(13分)右图是某学校实验室从化学试剂商店买回的硫酸试剂标签上的部分内容。某次学生实验需要0.5mol/LH2SO4溶液480ml,若由你来配制所需溶液,请根据实验室已有的仪器和药品情况回答下列问题:
①实验中除了量筒、烧杯外还需要的其它仪器有: ;
②计算所需浓硫酸的体积是 mL;若该硫酸与等体积的水混合时,所得溶液中溶质的质量分数 49%(填写“<”、“=”或“>”);
③配制过程中需先在烧杯中将浓硫酸进行稀释。稀释时操作方法是: ;
④下列操作会引起所配浓度偏大的是(填写字母) 。
A、用量筒量取浓硫酸时,仰视量筒的刻度
B、容量瓶未干燥即用来配制溶液
C、浓硫酸在烧杯中稀释后,未冷却就立即转移到容量瓶中,并进行定容;
D、往容量瓶转移时,有少量液体溅出
E、烧杯未进行洗涤
F、定容时俯视刻度线
G、定容后塞上瓶塞反复摇匀,静置后,液面不到刻度线,再加水至刻度线。
16、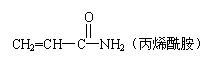 2002年瑞典科学家发现,某些高温油炸食品中含有一定量的丙烯酰胺:
2002年瑞典科学家发现,某些高温油炸食品中含有一定量的丙烯酰胺:
食品中过量的丙烯酰胺可能引起令人不安的食品安全问题。关于丙烯酰胺有下列叙述:①能使酸性KMnO4溶液褪色;②能发生加聚反应生成高分子化合物只③有4种同分异构体;④能与氢气发生加成反应。其中正确的是
A.①②③ B.②③④ C.①③④ D.①②④
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com