
题目列表(包括答案和解析)
23.(10分)已知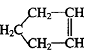 可简写为
可简写为
降冰片烯的分子结构可表示为: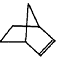
⑴降冰片烯属于__________。
a.环烃 b.不饱和烃 c.烷烃 d.芳香烃
⑵降冰片烯的分子式为__________。其二氯取代物共有 种。
⑶写出降冰片烯的所有含有一个六元环的单环化合物的同分异构体的结构简式 。
⑷降冰片烯不具有的性质__________。
a.能溶于水 b.能发生氧化反应 c.能发生加成反应 d.常温常压下为气体
22.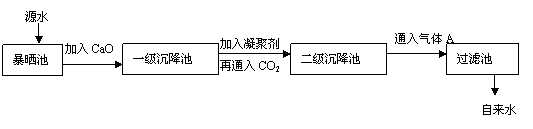 (10分)某综合实践活动小组到自来水厂进行参观,了解到源水处理成自来水的工艺流程示意图如下:
(10分)某综合实践活动小组到自来水厂进行参观,了解到源水处理成自来水的工艺流程示意图如下:
⑴源水中含Ca2+、Mg2+、HCO3-、Cl-等,加入CaO后生成Ca(OH)2,进而发生若干复分解反应,试写出其中的一个离子方程式 。
⑵加入凝聚剂可以除去其中的悬浮固体颗粒,其过程是 。(填写下列各项的序号)①只有物理过程,无化学过程 ②只有化学过程,无物理过程
③既有化学过程又有物理过程;
FeSO4·7H2O是常用的凝聚剂,加入后,最终生成红褐色胶状沉淀,则这种红褐色胶状沉淀是 。用化学反应方程式表示实验室制备该胶体的方法: 。
⑶通入二氧化碳的目的是 和 。
⑷气体A的作用是 。
⑸下列物质中, 可以作为气体A的代替品。(填写下列各项的序号)
①ClO2 ②浓氨水 ③SO2 ④浓硫酸
21.(6分) 某溶液中可能含有H+、Na+、NH4+、Mg2+、Fe3+、Al3+、SO42-
等离子,当向该溶液中加入某浓度的NaOH溶液时,发现生成沉淀的物质的量随NaOH溶液的体积变化如图所示,由此可知,该溶液中肯定含有的阳离子是_________(由少到多排列),且各离子的物质的量之比为_______;肯定不含的阳离子是_______________。
某溶液中可能含有H+、Na+、NH4+、Mg2+、Fe3+、Al3+、SO42-
等离子,当向该溶液中加入某浓度的NaOH溶液时,发现生成沉淀的物质的量随NaOH溶液的体积变化如图所示,由此可知,该溶液中肯定含有的阳离子是_________(由少到多排列),且各离子的物质的量之比为_______;肯定不含的阳离子是_______________。
20.(12分)物质之间的转化关系如下图所示,A可作为工业生产J的原料,B、C、H、I为非金属单质,X的水溶液为一种常见的医用消毒液,F为常见的红棕色防锈油漆颜料的主要成分,O是常见氮肥,且反应⑦中L与M的物质的量之比为1∶2,A、E、J、N中含有同一种元素。
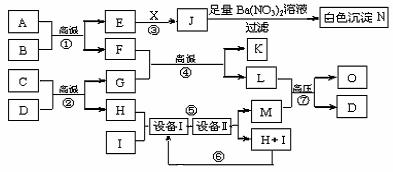
回答下列问题:
⑴X的化学式为 ,O的结构简式为 。
⑵考虑到综合经济效益,工业生产M时,可采取的措施有 (填序号)。
a.使用催化剂 b.适当降低温度 c.选择合适的温度 d.适度增大压强 e.及时分离出产物 f.对原料进行循环利用 g.充分利用反应本身放出的热量 h.工厂地址尽可能选择在交通发达的城市 j.工厂地址可选择在盛产天然气的地区
工业生产中为了节约资源、降低成本和保护环境,常常对某些物质进行循环利用。上述转化关系中能达到该目的的是 (填序号)。
⑶反应②化学反应方程式为 。
⑷现有1molA参加反应,假设各步均完全反应,生成N的质量为1165g,生成K的质量为224g,则反应①化学反应方程式为 。
19.(12分)A、B、C、D、E分别属于周期表中前20号元素,其原子序数依次递增,并且其中只有一种金属元素。A是元素周期表所有元素中原子半径最小的;B和C都只有两个电子层,B中一层电子数是另一层的两倍;C中两层电子数之和是两层电子数之差的两倍;D中一层电子数是另两层电子数之和;E的正二价阳离子电子层结构与氩原子相同。
请按要求回答下列问题:
⑴画出E原子的原子结构示意图 ,写出由A和C组成的含有非极性键的化合物的电子式 。
⑵由上述元素组成的化合物中属于极性键构成的非极性分子是
(只要求写出两种,用化学式表示)。
⑶由C与E形成的化合物高温时与单质B反应生成两种化合物,请写出该反应的化学方程式 。
⑷写出上述元素形成的化合物或者单质中:①一种可溶性的正盐与另一种强酸反应的离子方程式 ;②上述元素形成的化合物中通常能污染空气的是 (至少写出两种)。③某一种可污染空气的化合物与强氧化性单质常温下反应生成两种化合物,该反应的化学方程式为 。
18.(12分)某研究性学习小组研究HNO3的氧化性,设计了如下实验:
在盛有新制FeSO4溶液的试管中滴入2滴KSCN溶液,观察现象,然后再滴入几滴浓HNO3,溶液的颜色变红,但是将红色溶液放置一会儿则发现溶液由红色快速变为蓝色,并产生红棕色气体,这一奇特现象激起了同学的好奇心与求知欲望,对此现象设计了探究性实验。
⑴甲同学认为是溶液中的Fe2+的干扰造成的,大家经过理性分析,认为可以排除Fe2+的干扰,理由是________________________。
⑵乙同学认为红色消失,说明Fe(SCN)3被破坏,红棕色NO2说明了某些离子与HNO3发生了氧化还原反应,推测可能是KSCN与HNO3作用。KSCN溶液是一种无色液体,根据C、S、N的原子结构和共价键的相关知识推测SCN-的结构式为____________。
⑶根据乙同学的观点,设计了实验方案1,往浓HNO3中逐滴加入KSCN溶液,实验开始时无明显现象,一段时间后溶液慢慢变红色至深红色,突然剧烈反应产生大量气泡,放出红棕色气体,而溶液红色消失变为浅绿色,溶液温度升高;继续滴入KSCN,溶液变为浅蓝色,最后变成无色。将产生的气体通入过量的Ba(OH)2溶液,产生浑浊,并剩余一种非极性气体;向反应后的溶液中加入BaCl2溶液产生白色沉淀,写出向浓HNO3中滴入KSCN的离子方程式______________________。
⑷丙同学认为SCN-的性质还可进一步探究,设计了方案2,向Fe(SCN)3中分别滴加过量的氯水、溴水,溶液的红色均消失变为黄色,而加入碘水时溶液的颜色基本不变。丙同学的设计意图是____________________________。
⑸通过本次探究,可以得出以下结论,a、用SCN-间接检验Fe2+时应注意________;b、与SCN-反应使溶液变红的_______是Fe3+。(填“一定”或“不一定”)
17.(6分)下列实验操作或对实验事实的描述不正确的是____________ (填序号,错选一个倒扣2分,不出现负分)
A.用分液漏斗进行分液操作,将甘油和水的混合物分离;
B.从溴的四氯化碳溶液中提取溴,可用苯进行萃取;
C.用热的浓HCl洗涤附着有MnO2的试管;
D.在硫酸铜晶体结晶水含量的测定中,若加热后的无水硫酸铜粉末表面发黑,则所测结晶水含量可能会偏高 ;
E.用碱式滴定管量得KMnO4溶液20.50mL ;
F.实验室快速制备少量H2、O2、NH3、HCl可以用同一种气体发生装置;
G.只用水一种试剂就能将CuSO4、Na2CO3、CaC2三种固体粉末鉴别;
H.用NaOH溶液和FeSO4溶液制备Fe(OH)2时,吸有NaOH溶液的胶头滴管末端应插入FeSO4溶液液面之下;
16.某学生用NaHCO3和KHCO3组成的某混合物进行实验,测得如下数据(盐酸的物质的量浓度相等),下列分析推理不正确的是
|
|
50mL盐酸 |
50mL盐酸 |
50mL盐酸 |
|
m(混合物) |
9.2g |
15.7g |
27.6g |
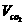 (标况) (标况) |
2.24L |
3.36L |
3.36L |
A.盐酸的物质的量浓度为3.0 mol·L-1
B.根据表中数据不能计算出混合物中NaHCO3的质量分数
C.加入混合物9.2g时盐酸过量 D.15.7g混合物恰好与盐酸完全反应
第二卷(非选择题 共86分)
15.两种硫酸盐按一定比例混合后共熔,可制得化合物X,X溶于水能电离出K+、Cr3+、SO42-,若将2.83 g X中的Cr3+全部氧化为Cr2O72-后,溶液中的
Cr2O72-可和过量KI溶液反应,得到3.81gI2,反应的离子方程式为:
Cr2O72-+6I-+14H+=2 Cr3++3I2+7H2O 。若向溶有2.83 gX的溶液中,加入过量的BaCl2溶液,可得到4.66 g白色沉淀.由此可推断出X的化学式为
A.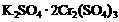 B.
B.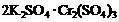
C.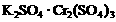 D.
D.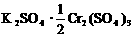
14.氯酸是一种强酸,浓度超过40%时会发生分解,反应可表示为:aHClO3=bO2↑+cCl2↑+dHClO4+eH2O,用湿润的淀粉碘化钾试纸检验气体产物时,试纸先变蓝后褪色。下列说法正确的是
A.物质HClO4的氧化性大于HClO3
B.变蓝的淀粉碘化钾试纸褪色可能发生的反应:
5C12+I2+6H2O=12H++10Cl-+2IO3-
C.若化学计量数a=8,b=3,则该反应转移电子数为20e-
D.氯酸分解所得O2和C12的物质的量之比是确定不变的
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com