
题目列表(包括答案和解析)
8.A是一种常见的单质,B、C为中学常见的化合物,A、B、C均含有元素X。它们有如下的转化关系(部分产物及反应条件已略去):
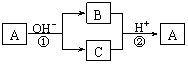
下列判断正确的是( )
A.X元素可能为Al B.X元素一定为非金属元素
C.反应①和②互为可逆反应 D.反应①、②不一定为氧化还原反应
7.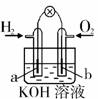 燃料电池是目前电池研究的热点之一。现有某课外小组自制的氢氧燃料电池,如右图所示,a、b均为惰性电极。下列叙述不正确的是
燃料电池是目前电池研究的热点之一。现有某课外小组自制的氢氧燃料电池,如右图所示,a、b均为惰性电极。下列叙述不正确的是
A.a极是负极,该电极上发生氧化反应
B.b极反应是O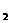 +4OH
+4OH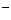 -4e
-4e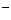 =2H
=2H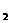 O
O
C.总反应方程式为2H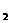 +O
+O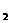 =2H
=2H O
O
D.氢氧燃料电池是一种具有应用前景的绿色电源
6.下列关于晶体的说法一定正确的是
 A.第ⅠA碱金属元素与ⅦA元素所形成的化合物在固态时为离子晶体,晶体中阴、阳离子排列方式相同
A.第ⅠA碱金属元素与ⅦA元素所形成的化合物在固态时为离子晶体,晶体中阴、阳离子排列方式相同
B.晶体中存在阴离子就必定存在阳离子,存在阳离子就必定存在阴离子
C.离子晶体中只含有离子键,分子晶体、原子晶体中必定含有共价键
D.C60晶体(其结构模型如上图)中每个C60分子周围与它距离最近且等距离的C60分子有12个
5.X、Y元素的原子,在化学反应中都容易失去电子而形成与Ne相同的电子层结构,已知X的原子序数比Y的原子序数大,下列说法中正确的是 ( )
A.X的金属性比Y的金属性强
B.常温下,X和Y都不能从水中置换出氢
C.Y元素的最高价氢氧化物碱性比X元素最高价氢氧化物碱性强
D.Y元素的最高化合价比X元素的最高化合价高
4. 100℃时,将0.1molN2O4置于1L密闭的烧瓶中,然后将烧瓶放入100℃的恒温槽中,烧瓶内的气体逐渐变为红棕色:N2O4(g)
 2NO2 (g)。下列结论不能说明上述反应在该条件下已经达到平衡状态的是
2NO2 (g)。下列结论不能说明上述反应在该条件下已经达到平衡状态的是
①烧瓶内气体的颜色不再加深,②N2O4 的消耗速率与NO2的生成速率之比为1∶2,③NO2的生成速率与NO2消耗速率相等,④NO2的物质的量浓度不变,⑤烧瓶内气体的质量不再变化,⑥烧瓶内气体的压强不再变化,⑦烧瓶内气体的密度不再变化,⑧烧瓶内气体的平均相对分子质量不再变化
A.②⑤⑦ B.①③④⑥⑧ C.只有③ D.只有⑤
3.分析下图所示的四个原电池装置,其中结论正确的是
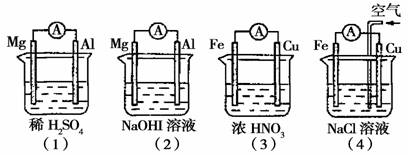
A.(1)(2)中Mg作负极,(3)(4)中Fe作负极
B.(2)中Mg作正极,电极反应式为:6H2O+6e-→6OH-+3H2↑
C.(3)中Fe作负极,电极反应式为:Fe→Fe2++2e-
D.(4)中Cu作正极,电极反应式为:2H++2e-→H2↑
2.我国神舟六号飞船发射时用肼(N2H4)作为火箭发动机的燃料,NO2为氧化剂,反应生成氮气和水蒸气。已知:N2(g)+2O2(g)=2NO2(g)△H=+67.7kJ•mol-1,N2H4(g)+O2(g)=N2(g)+2H2O(g)△H=-534 kJ•mol-1。关于肼和二氧化氮反应的热化学方程式中正确的是
A.2N2H4(g)+2NO2(g)=3N2(g)+4H2O(l)△H=-1135.7kJ•mol-1
B.2N2H4(g)+2NO2(g)=3N2(g)+4H2O(g)△H=-1135.7kJ•mol-1
C.N2H4(g)+NO2(g)=3/2N2(g)+2H2O(g)△H=-1135.7kJ•mol-1
D.2N2H4(g)+2NO2(g)=3N2(g)+4H2O(g)△H=+1135.7kJ•mol-1
1.查阅资料发现,金属钠不仅能跟氧气和水反应.还能跟多种其它物质发生反应,其中包括与酒精在常温下反应。要研究金属钠跟酒精反应的性质以及它与水反应的异同点, 下列的研究方法中没有用到的是
A.实验法 B.观察法 C.分类法 D.比较法
25.(10分)铜是人类最早知道的金属之一,实验室可用H2还原CuO制取少量的Cu,工业上主要用火法从黄铜矿中提炼Cu。
Ⅰ、实验表明,CuO被H2还原时也有Cu2O生成。将一定量的H2缓慢通过灼热的CuO粉末,得到固体混合物且混合物中m(Cu) ∶m(O)=8∶a。当a有不同的取值时,固体混合物成份不同。请分析a的取值范围和固体混合物成份的关系并填入下表(不一定填满,表格不够也可自行增加);
|
a的取值范围 |
反应后固体的成分(用化学式表示) |
|
|
|
|
|
|
|
|
|
Ⅱ、 黄铜矿的主要成分X是由Cu、Fe、S三种元素组成的复盐,其中Cu、Fe两种元素的质量比为8∶7;将m g X粉末全部溶于200 mL的浓HNO3,反应后的溶液加水稀释至 2.12 L时测得其pH为0;将稀释后的溶液分为两等份,向其中一份溶液中滴加6.05mol/L的NaOH溶液,向另一份溶液中滴加0.600mol/L Ba(NO3)2溶液,两溶液中均生成沉淀,且沉淀的质量随所加溶液的体积变化如下图所示:
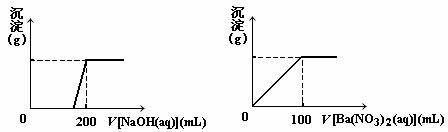
⑴ 请通过计算确定m的值;
⑵ X的摩尔质量为368 g/mol,请确定X的化学式。
24.(8分)某烃0.1mol与0.7mol氧气混合后,在一密闭容器中充分燃烧。所得产物通过浓硫酸时,浓硫酸增重10.8g,再通过灼热氧化铜粉末,固体质量减轻3.2g,最后通过足量的过氧化钠粉末时,固体质量又增加了14.0g。试通过计算确定该烃的分子式;写出其一氯代物只有一种的结构简式并用系统命名法命名。
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com