
题目列表(包括答案和解析)
5.下列可逆反应达到平衡后,增大压强或降低温度,都可以使化学平衡向正反应方向移动的是( )
A.2SO2 +
O2 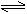 2SO3,ΔH<0 B.4NH3 + 5O2
2SO3,ΔH<0 B.4NH3 + 5O2 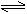 4NO + 6H2O(g),ΔH<0
4NO + 6H2O(g),ΔH<0
C.2NH3 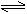 N2
+ 3H2,ΔH>0 D.SO2 + NO2
N2
+ 3H2,ΔH>0 D.SO2 + NO2 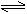 SO3(g)
+ NO,ΔH<0
SO3(g)
+ NO,ΔH<0
4.A和B在溶液中进行如下的可逆反应 A + B 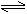 AB .反应开始时,溶液中只有A和B,反应过程中A、B、AB的物质的量浓度随时间变化的曲线图正确的是( )
AB .反应开始时,溶液中只有A和B,反应过程中A、B、AB的物质的量浓度随时间变化的曲线图正确的是( )
|
3.下列说法中,错误的是 ( )
A.使用催化剂能够降低反应所需能量,增大反应物分子中活化分子所占百分数,从而增大反应速率
B.增大反应物浓度,可以增大反应物分子中活化分子的百分数,从而增大反应速率
C.升高温度,可以增大反应物分子中活化分子的百分数,增大反应速率
D.参加反应的物质的性质是决定化学反应速率的主要因素
2.有可逆反应 A(g) + 2B(g) 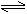 2C(g),ΔH>0. 达到化学平衡后,将反应混合物的温度降低,下列叙述中正确的是( )
2C(g),ΔH>0. 达到化学平衡后,将反应混合物的温度降低,下列叙述中正确的是( )
A.正反应速率加快,逆反应速率减慢,平衡向正反应方向移动
B.正反应速率减慢,逆反应速率加快,平衡向逆反应方向移动
C.正反应速率和逆反应速率都加快,平衡不移动
D.正反应速率和逆反应速率都减慢 ,平衡向逆反应方向移动
1.下列各组实验中,反应速率最快的是( )
|
组号 |
反应温度(℃) |
参 加 反 应 的 物 质 |
||||
|
Na2S2O3 |
H2SO4 |
H2O体积(mL) |
||||
|
体积(mL) |
浓度(mol/L) |
体积(mL) |
浓度(mol/L) |
|||
|
A. |
10 |
5 |
0.1 |
10 |
0.1 |
5 |
|
B. |
10 |
5 |
0.1 |
5 |
0.1 |
10 |
|
C. |
30 |
5 |
0.1 |
5 |
0.1 |
10 |
|
D. |
30 |
5 |
0.2 |
5 |
0.2 |
10 |
28.(14分)已知: CH3-CH=CH2 + HBr → CH3-CHBr-CH3
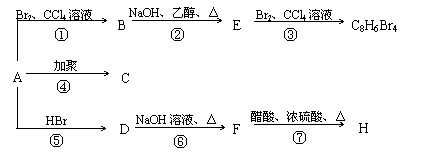 1mol某烃A充分燃烧后可以得到8 mol CO2和4 mol H2O。该烃A 在不同条件下能发生下图所示的一系列变化。
1mol某烃A充分燃烧后可以得到8 mol CO2和4 mol H2O。该烃A 在不同条件下能发生下图所示的一系列变化。
(1)A的化学式: A的结构简式:
(2)上述反应中,①是 反应,⑦是 反应。(填反应类型)
(3)写出C、D、E、H物质的结构简式:
C , D ,
E , H 。
(4)写出D → F反应的化学方程式
27.(7分)某有机化合物A含碳77.8%,氢为7.40%,其余为氧,A的相对分子质量为甲
烷的6.75倍。
(1)该有机物的分子式为
(2)据此确定该有机物含苯环的所有可能的结构简式。
26.(12分)A-J是中学化学中常见的几种物质,它们之间的转化关系如下图所示。已知常温下A为固体单质,B为淡黄色粉末,C、F、I为气态单质,E在常温下为液体,且E可由C、F化合生成,J可作禽流感、SARS等病毒的杀菌消毒剂。

(1)写出E的电子式:_____________________。
(2)写出反应⑦的离子方程式: 。
(3)向AlCl3溶液中加入少量固体B,写出反应的化学方程式:___________________。
(4)以Pt为电极电解滴加有少量酚酞的H饱和溶液,则阳极的电极反应式为:
__________________。________极(填“阴”或“阳”)附近溶液由无色变为红色,其原因
是:__________________________________________________________________。
25.(11分)某化学兴趣小组,专门研究了氧族元素及其某些化合物的部分性质。所查资料如下:
(1)碲(Te)为固体,H2Te为气体,Te和H2不能直接化合生成H2Te
(2)等物质的量氧气、硫、硒、碲与H2反应的焓变情况如图所示:
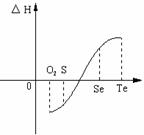
请回答下列问题:
(1)H2与硫化合的反应 热量(填“放出”或“吸收”)。
(2)根据题目所给信息,请解释为什么Te和H2不能直接化合
。
(3)H2S的水溶液显弱酸性,写出其电离方程式 ;在一定温度下,它的第一级电离常数可用 Ka表示,Ka 值越大,表示_________________,Ka值大小与温度的关系是:温度升高,Ka 值__________(填“一定增大”、“一定减小”、或“可能增大也可能减小”)。
(4)在容积均为1 L(容器体积不可变)的甲、乙两个容器中,分别加入2 mol SO2、
1 mol O2 和4 mol SO2、2 mol O2,在相同温度、催化剂下使其反应。最终达到平衡后,两容器中SO2转化率分别为α甲、α乙,甲容器中平衡常数表达式为 ,此时α甲 α乙(填“大于”、“小于”或“等于”)。
24.(8分) 化学中用类比的方法可预测许多物质的性质。
如根据H2+Cl2 2HCl 推测:H2+Br2
2HCl 推测:H2+Br2 2HBr。但类同是相对的,如根据2Na2O2+2CO2
2HBr。但类同是相对的,如根据2Na2O2+2CO2 2Na2CO3+O2 类推:2Na2O2+2SO2
2Na2CO3+O2 类推:2Na2O2+2SO2 2Na2SO3+O2是错误的,应该为:Na2O2+SO2
2Na2SO3+O2是错误的,应该为:Na2O2+SO2 Na2SO4。
Na2SO4。
⑴下列各组类比中正确的是 。
A.NH4Cl NH3↑+HCl 推测:NH4I
NH3↑+HCl 推测:NH4I NH3↑+HI↑
NH3↑+HI↑
B.由CO2+Ca(ClO)2+H2O CaCO3↓+2HClO
CaCO3↓+2HClO
推测:SO2+Ca(ClO)2+H2O CaSO3↓+2HClO
CaSO3↓+2HClO
C.由2CO2+Ca(ClO)2+2H2O Ca(HCO)2+2HClO
Ca(HCO)2+2HClO
推测:CO2+NaClO+H2O NaHCO3+HClO
NaHCO3+HClO
D.由Na2SO3+2HCl 2NaCl+H2O+SO2↑
2NaCl+H2O+SO2↑
推测:Na2SO3+2HNO3 2NaNO3+H2O+SO2↑
2NaNO3+H2O+SO2↑
⑵根据2Na
+ 2H2O 2NaOH
+ H2↑的反应推断Na与液NH3反应的方程式为:
2NaOH
+ H2↑的反应推断Na与液NH3反应的方程式为:
________________________________________________________________。
⑶由氢氧化铁与盐酸反应生成氯化铁和水,应用有关化学知识,推断写出氢氧化铁与氢碘酸反应的化学方程式_________________________________________________________。
⑷从2F2+2H2O 4HF+O2反应预测2F2+4NaOH
4HF+O2反应预测2F2+4NaOH 4NaF+2H2O+O2,然而经实验,物质的量相等的氟气和氢氧化钠正好完全反应,生成氟化钠、水和放出一种气体,请根据实验结果写出化学反应方程式____________________________________________________。
4NaF+2H2O+O2,然而经实验,物质的量相等的氟气和氢氧化钠正好完全反应,生成氟化钠、水和放出一种气体,请根据实验结果写出化学反应方程式____________________________________________________。
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com