
题目列表(包括答案和解析)
23.(6分)
溶液变红;纯碱水解后溶液呈碱性(CO32- + H2O = HCO32- + OH-)
溶液红色变浅至消失;由于反应Ca2+ + CO32+ = CaCO3 发生 CO32+的浓度减小,OH-的浓度也减小。
22.(8分)
(1)770, 890
(2)①降低压强或移去钾蒸气②适当升高温度
(3)C(K)/C(Na)
|
12 |
13 |
14 |
15 |
16 |
17 |
18 |
19 |
20 |
21 |
|
AB |
D |
B |
AB |
AC |
A |
B |
AD |
BD |
AD |
|
1 |
2 |
3 |
4 |
5 |
6 |
7 |
8 |
9 |
10 |
|
C |
C |
A |
A |
C |
C |
A |
A |
B |
B |
|
11 |
|
|
|
|
|
|
|
|
|
|
B |
|
|
|
|
|
|
|
|
|
30.(16分)恒温下,将a mol N2与b mol H2的混合气体通入一个固定容积的密闭容器中,发生如下反应:N2 (g) + 3 H2(g)
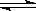 2NH3(g)
⑴若反应达平衡时某时刻t时,nt (N2) = 13mol,nt (NH3) = 6mol,计算a的值
⑵反应达平衡时,混合气体的体积为726.8L(标况下),其中NH3的含量(体积分数)为25%。计算平移时NH3的物质的量。(注:Vm=22.4mol/L)
⑶原混合气体与平衡混合气体的总物质的量之比(写出最简整数比,下同),n(始)∶n(平)
= 。
⑷原混合气体中,a∶b = 。
⑸达到平衡时,N2和H2的转化率之比,α(N2)∶α (H2)= 。
⑹平衡混合气体中,n(N2)∶n(H2)∶n(NH3) = 。
2NH3(g)
⑴若反应达平衡时某时刻t时,nt (N2) = 13mol,nt (NH3) = 6mol,计算a的值
⑵反应达平衡时,混合气体的体积为726.8L(标况下),其中NH3的含量(体积分数)为25%。计算平移时NH3的物质的量。(注:Vm=22.4mol/L)
⑶原混合气体与平衡混合气体的总物质的量之比(写出最简整数比,下同),n(始)∶n(平)
= 。
⑷原混合气体中,a∶b = 。
⑸达到平衡时,N2和H2的转化率之比,α(N2)∶α (H2)= 。
⑹平衡混合气体中,n(N2)∶n(H2)∶n(NH3) = 。
29.(12分)I.恒温、恒压下,在一个可变容积的容器中发生如下发应:
A(气)+B(气)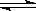 C(气)
C(气)
(1)若开始时放入1molA和1molB,到达平衡后,生成a molC,这时A的物质的量为 mol。
(2)若开始时放入3molA和3molB,到达平衡后,生成C的物质的量为 mol。
(3)若开始时放入x molA,2molB和1molC,到达平衡后,A和C的物质的量分别是ymol和3a mol,则x= mol,y= mol。
平衡时,B的物质的量 (选填一个编号)
(甲)大于2 mol (乙)等于2 mol
(丙)小于2 mol (丁)可能大于、等于或小于2mol
作出此判断的理由是 。
(4)若在(3)的平衡混合物中再加入3molC,待再次到达平衡后,C的物质的量分数是 。
II.若维持温度不变,在一个与(1)反应前起始体积相同、且容积固定的容器中发生上述反应。
(5)开始时放入1molA和1molB到达平衡后生成b molC。将b与(1)小题中的a进行比较 (选填一个编号)。
(甲)a<b (乙)a>b (丙)a=b (丁)不能比较a和b的大小
作出此判断的理由是 。
28.(5分)常温下,某强酸溶液PH= a , 强碱溶液pH= b,已知 a+b=12,酸碱溶液混合后pH=7,则酸溶液体积V(酸)和V(碱)的正确关系为__________________,若其它条件不变a+b=15则V(酸)与V(碱)关系___________________.
27.(12分)往有机聚合物中添加阻燃剂,可增加聚合物的使用安全性,扩大其应用范围。例如,在某聚乙烯树脂中加入等质量由特殊工艺制备的阻燃型Mg(OH)2,树脂可燃性大大降低。该Mg(OH)2的生产工艺如下:

⑴精制卤水中的MgCl2与适量石灰乳反应合成碱式氯化镁[Mg(OH)2-xClx·mH2O], 反应的化学方程式为 。
.... ⑵合成反应后,继续在393K-523K下水热处理8h,发生反应:
[Mg(OH)2-xClx·mH2O]==(1-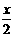 )Mg(OH)2+
)Mg(OH)2+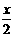 MgCl2+mH2O
MgCl2+mH2O
水热处理后,过滤、水洗。水洗的目的是 。
⑶阻燃型Mg(OH)2具有晶粒大,易分散、与高分子材料相容性好等特点。上述工艺流程中与此有关的步骤是 。
⑷已知热化学方程式:
Mg(OH)2(s)==MgO(s)+H2O(g); △H1=+81.5kJ·mol-1
Al(OH)3(s)=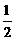 Al2O3(s)+
Al2O3(s)+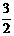 H2O(g); △H2=+87.7kJ·mol-1
H2O(g); △H2=+87.7kJ·mol-1
①Mg(OH)2和Al(OH)3起阻燃作用的主要原因是 。
②等质量Mg(OH)2和Al(OH)3相比,阻燃效果较好的是 , 原因是 。
⑸常用阻燃剂主要有三类:A.卤系,如四溴乙烷;B.磷系,如磷酸三苯酯;C.无机类,主要是Mg(OH)2和Al(OH)3。从环保的角度考虑,应用时较理想的阻燃剂是 ________(填代号),理由是 。
25.(4分)写出下列各反应的热化学方程式
(1) 1molC和1molH2O(g)反应生成1mol(g)和1mol H2(g),需要吸收131.5kJ的热量____________________________________________
(2) 13gC2H2(g)完全燃烧生成CO2和H2O(l)时,放出659kJ的热量。______________________________________________________
24.(10分)在密闭容器中,有一定起始浓度的氙(Xe)和F2反应,
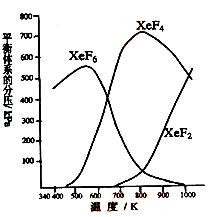 可得到三种氟化物。各种生成物在平衡体系内的分压与
可得到三种氟化物。各种生成物在平衡体系内的分压与
反应温度的关系如右图所示(已知气体的分压之比等于
物质的量之比)。
⑴ 420K时,发生反应的化学方程式为:
________________________________________,
若反应中消耗1 mol Xe,则转移电子______mol。
⑵ 600~800K时,会发生反应:
XeF6(g) 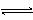 XeF4(g)
+ F2(g) , 其反应热
XeF4(g)
+ F2(g) , 其反应热
△H________0(填“>”、“=”或“<”),理由是
__________________________________________。
⑶ 900K时,容器中存在的组分有_________________。
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com