
题目列表(包括答案和解析)
22、(10分)某有机物的相对分子质量为58,根据下列条件回答下列问题:
(1)若有机物只由碳、氢两种元素组成,则该有机物可能的结构简式为:
__________________________________________________________________________
(2)若为烃的含氧衍生物,且分子中有-CH3,则可能的结构简式为:
____________________________________________________________________________
(3)若分子中无-CH3,又无-OH,但能发生银镜反应,则结构简式为:
___________________________________________________________________________
21、(12分)2005年10月12日9时,我国在酒泉卫星发射中心成功的发射了“神舟”六号载人飞船。将两名航天员同时送上太空,并于10月17日凌晨成功返回,为我国的航天事业写下了新的篇章。 (1)火箭升空时,由于与大气层的剧烈摩擦,产生高温。为了防止火箭温度过高,在火箭表面涂上一种特殊的涂料,该涂料的性质最可能的是________; A、在高温下不融化 B、在高温下可分解气化 C、在常温下就分解气化 D、该涂料不可能发生分解 (2)火箭升空需要高能的燃料,经常是用N2O4和N2H4作为燃料,其反应的方程式是: ----N2O4 + ----N2H4 → ----N2 + ----H2O,请配平该反应方程式。该反应中被氧化的原子与被还原的原子物质的量之比是 。这个反应应用于火箭推进器,除释放大量的热和快速产生大量气体外,还有一个很大的优点是 。
(3)右图是某空间站能量转化系统的局部示意图,其中燃料电池采用KOH为电解液,
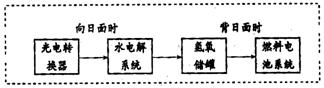 水电解系统中的阳极反应为:
水电解系统中的阳极反应为:
燃料电池放电时的负极反应:
20、(8分)(1) 室温下取0.2mol·L-1盐酸与0.2mol·L-1 MOH溶液等体积混合(忽略混合后溶液体积的变化),测得混合溶液的pH=6,试回答以下问题:
① 混合液中水电离出的c(H+)_________原盐酸中水电离出的c(H+);(填“>”、“<”、或“=”),
② 求出混合溶液中下列算式的精确计算结果(填具体数字):
c(Cl-) - c(M+) = __________ mol·L-1 c(H+) - c(MOH) = ___________ mol·L-1
(2) 室温下如果取0.2mol·L-1 MOH溶液与0.1 mol·L-1 HCl溶液等体积混合,测得混合溶液的pH<7,则溶液中各离子浓度由大到小的顺序为
19、(8分)A为甲、乙两种短周期元素组成的化合物,其摩尔质量为100g·mol-1,甲元素的原子最外层电子数与K层相等,乙元素的氢化物水溶液显碱性。C为单质,其原子半径在周期表中最小。D为气体,其密度为相同条件下空气密度的1.103倍。K为乙元素的单质。在适当的条件下,它们之间有如下图所示的转化关系:
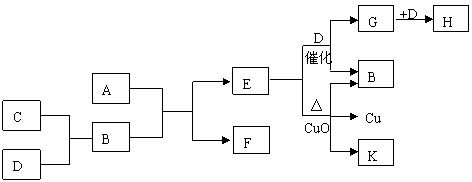
试填写下列空白:
(1)A的化学式为 ,K分子的结构式为 ;
(2)完成下列有关反应的化学方程式
E + D  G + B
G + B
E + CuO:
(3)E与G在一定条件下若能反应,写出化学方程式;若不能,则说明理由。
18、 (12分)某校研究性学习小组选择使用下列仪器和药品,验证由铜和适量浓硝酸反
(12分)某校研究性学习小组选择使用下列仪器和药品,验证由铜和适量浓硝酸反
应产生的气体中含有NO(实验中使用的N2和O2的用量可自由控制)。
已知:①NO + NO2 + 2OH-= 2NO2-+ H2O ②气体液化温度:NO2:21℃、NO:-152℃
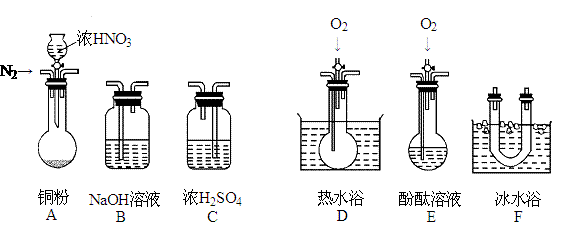 (1)现有甲、乙两位同学分别设计了以下两个实验方案(用仪器的连接顺序表示)。
(1)现有甲、乙两位同学分别设计了以下两个实验方案(用仪器的连接顺序表示)。
甲:A→C→F→D→B 乙:A→B→C→E
甲、乙两位同学提出的实验方案是否能验证Cu与适量浓HNO3反应产生的气体
中含有NO(填“能”或“不能”),如不能验证,请简要说明主要原因。
甲方案:
乙方案:
(2)对于你认为可行的方案认真分析,回答下列问题:(如你认为都不可行,下列问题不用回答)
①实验开始时首先通入足量的N2,其目的是:
②确认气体中含NO的现象是:______________________________________________。
③B装置的作用是 ,如果O2过量,则装置B中发生反应的离子方程式是: 。
17、(6分)(1) 指出下列实验用品或仪器(已洗涤干净)使用时的第一步操作:
 ① 石蕊试纸(检验气体性质)________________
① 石蕊试纸(检验气体性质)________________
② 容量瓶
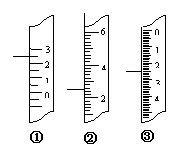
(2)右图分别是温度计、量筒、滴定管的一部分,下述读数及说法
正确的是 。
A、①是量筒,读数为2.5mL B、②是量筒,读数为2.5mL




 C、③是滴定管,读数为3.5mL D、①是温度计,读数为2.5℃
C、③是滴定管,读数为3.5mL D、①是温度计,读数为2.5℃
16、 某二元酸(H2A)按下式发生电离:H2A
= H++HA-;HA- H++A2-。关于下列四种溶液的说法正确的是
某二元酸(H2A)按下式发生电离:H2A
= H++HA-;HA- H++A2-。关于下列四种溶液的说法正确的是
①0.01mol/L的H2A溶液 ②0.01mol/L的NaHA溶液
③0.02mol/L的HCl溶液与0.04mol/L的NaHA溶液等体积混合
④0.02mol/L的NaOH溶液与0.02mol/L的NaHA溶液等体积混合
A、四种溶液中c(HA-)浓度大小:③>①>②>④
B、溶液①中粒子浓度大小顺序是:c(H2A)>c(H+)>c(HA-)>c(A2-)>c(OH-)
C、溶液②中有关离子浓度关系:c(HA-)+2c(A2-)+c(H2A)=c(Na+)
D、溶液③中有关离子浓度关系:c(HA-)+c(A2-)+c(OH-)=c(Na+)+c(H+)
第Ⅱ卷(非选择题 共86分)
15、室温下,由水电离得到的c(H+)为1×10-12的无色溶液中,可能大量共存的离子组有:
A、K+、S2-、HSO3-、Na+ B、I-、Na+、SO42-、NO3-
C、Na+、Fe2+、Br-、Cl- D、AlO2-、K+、NH4+、Na+
14、如图是在MgCl2、AlCl3混和溶液中,加入a或b时,沉淀物
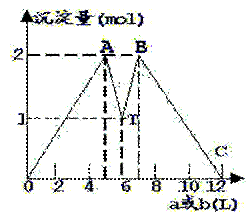 的量与加入的a或b的量的关系图,以下结论正确的是
的量与加入的a或b的量的关系图,以下结论正确的是
①T之前加NaOH溶液, T之后加盐酸
②T之前加盐酸, T之后加NaOH溶液
③混和液c(AlCl3):c(MgCl2)=1:1
④图中所消耗的NaOH和HCl物质的量之比是3:1
⑤该盐酸与NaOH溶液的物质的量浓度相同
A、①③④ B、①③⑤
C、②③④ D、②③⑤
13、将2 mol X、3 mol Z两种气体混合于某体积不变的密闭容器内发生如下反应:
2X(g )+Y(g)  3
Z(g),平衡时,生成n mol Z。恒温恒压时,按下列配比投入各物质,达到平衡时,Z的物质的量大于n mol的是
3
Z(g),平衡时,生成n mol Z。恒温恒压时,按下列配比投入各物质,达到平衡时,Z的物质的量大于n mol的是
A、3.2 mol X、0.6 mol Y、1.2 mol Z B、3.6 mol X、1 mol Y、0.6 mol Z
C、2.8 mol X、0.4 mol Y、1 mol Z D、2.2 mol X、0.2 mol Y、2.4 mol Z
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com