
题目列表(包括答案和解析)
28.(共10分)将NaOH、BaCl2、Al2(SO4)3三种固体组成的混合物溶于足量的水中,充分溶解.用1mol/L稀硫酸滴定,加入稀硫酸的体积与生成沉淀的质量的关系如图所示.
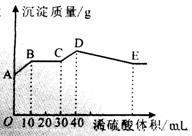 (1)A-B段所发生反应离子方程式是
;
(1)A-B段所发生反应离子方程式是
;
(2)D点所表示的沉淀的化学式是 ;
(3)B点所表示的沉淀的质量是 g;
(4)沉淀质量为10.1g时,通过计算求需加入稀硫酸的总体积是多少毫升?
27.(6分)在一定条件下,NO跟NH3可以发生反应生成N2和H2O。现有NO和NH3的混合物1mol,充分反应后所得产物中,若经还原得到的N2比经氧化得到的N2多1.4g。
(1)写出反应的化学方程式并标出电子转移的方向和数目。
(2)若以上反应进行完全,试计算原反应混合物中NO与NH3的物质的量可能各是多
少。
25.(12分)摩尔盐[(NH4)2SO4·FeSO4·6H2O]在空气中比一般亚铁盐稳定,是分析化学中常见的还原剂。某研究性学习小组设计了下面的实验装置来制备摩尔盐。
实验步骤:
(1)把30%NaOH溶液和废铁屑混合、煮沸、冷却,将洗涤铁屑后的NaOH溶液装入F中。
(2)在E中用处理过的Fe屑和稀H2SO4反应制取FeSO4。
(3)将硫酸亚铁溶液与硫酸铵溶液混合,结晶得摩尔盐。
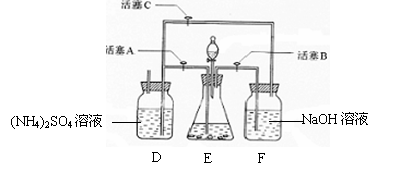
试回答下列问题:
(1)F中的NaOH溶液的主要作用是
(2)Fe屑和稀H2SO4反应产生的氢气可赶走装置中的氧气及(NH4)2SO4溶液中的溶解氧,操作
时应先关闭活塞 ,并同时打开活塞 。
请写出Fe屑和稀H2SO4反应产生的氢气的另外一个作用
(3)使摩尔盐结晶可采取两种方法:①蒸发溶液、再自然冷却结晶;②不蒸发溶液、直接自然冷却结晶。你认为较好的方法是 。(填序号)
(4)原料利用率高,副产品少,产生的有害废物少,保护环境是“绿色化学”的主要内涵。
请写出此实验中能体现“绿色化学”的具体做法(至少写出两点):
、 。
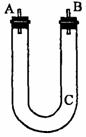 26.( 8分)通过测量一定质量的Fe,Al合金与A的溶液反应生成C气体在标准状况下的体积,可以计算出合金中Fe和Al的质量分数.若以下图装置来制取
26.( 8分)通过测量一定质量的Fe,Al合金与A的溶液反应生成C气体在标准状况下的体积,可以计算出合金中Fe和Al的质量分数.若以下图装置来制取 ,请完成下列操作直至产生氢气.
,请完成下列操作直至产生氢气.
①C处塞入玻璃丝绒团;
②___________________________________________________;
③___________________________________________________;
④____________________________________________________;
⑤____________________________________________________;
⑥从分液漏斗中加入A的溶液.
五:计算题(共16分)
24.(8分)拟用下图装置制取表中的四种干燥、纯净的气体(图中铁架台、铁夹、加热及气体收集装置均已略去;必要时可以加热;a、b、c、d表示相应仪器中加入的试剂)。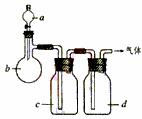
|
气体 |
a |
b |
c |
d |
|
CO2 |
盐酸 |
石灰石 |
饱和NaHCO3溶液 |
浓H2SO4 |
|
Cl2 |
浓盐酸 |
MnO2 |
NaOH溶液 |
浓H2SO4 |
|
NH3 |
饱和NH4Cl溶液 |
消石灰 |
H2O |
固体NaOH |
|
NO |
稀HNO3 |
铜屑 |
H2O |
P2O5 |
(1)上述方法中可以得到干燥、纯净的气体是 。
(2)指出不能用上述方法制取的气体,并说明理由(可以不填满)
①气体 ,理由是 。
②气体 ,理由是 。
③气体 ,理由是 。
23.(8分)已知甲、乙、丙为常见单质,A、B、C、D、E、F、G、H均为常见的化合物;B和H的摩尔质量相同,E的式量比D的式量大16,在一定条件下,各物质相互转化关系如下图所示(产物中水已忽略):
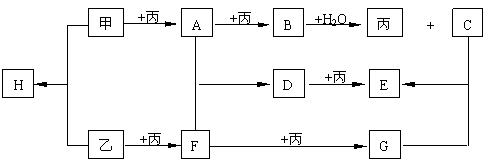
(1)写出下列物质的化学式:丙 H
(2)写出下列变化的离子方程式:
B+H2O → 丙+C :
(3)乙+丙→ F是工业上得到F的反应之一,请写出工业上得到F的另一化学反应方程式:
22.(8分)下表是元素周期表的一部分。表中所列的字母分别代表某一化学元素。
|
A |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
B |
C |
D |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
E |
F |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
(1)B和E的最高价氧化物对应的水化物中酸性较强的是 (填化学式)
写出可以验证该结论的一个离子反应方程式
(2)王水可溶解不能与硝酸反应的金属如Au、Pt等,其原因是王水中不仅含有HNO3、还有反应生成的Cl2和NOCl,假设NOCl中所有原子都达到了8电子稳定结构,试写出NOCl的电子式 。
(3)EBC-和A2D2反应生成了ED42-和可参加大气循环的两种无毒无害气体,试写出该反应的离子方程式
21.(5分)某研究性学习小组的一个课题是“NO2能否支持木条的燃烧?”由于实验室中没有现成的NO2气体,该小组的同学设计了一个方案(忽略N2O4的存在)。
(1)硝酸铜固体加热分解的产物有氧化铜、二氧化氮和氧气,该反应的化学方程式 。
(2)当集气瓶中充满红棕色气体时,木条复燃了,有的同学得出“NO2能支持木条燃烧”的结论。你认为这一观点是否正确?_______________________________理由是什么_____________________________________________________________________________?
20.(18分)(1)硅酸盐工业就是________________________________________, 其中水泥的生产原料是_________________________________,产品的主要成分是_______________________,加入石膏的目的是________________________。钢化玻璃的成分是________________________生产中发生化学反应的方程式是_________________________,___________________________。
(2)自然界氮的固定是_______________,_______________________________,工业上制法得的50%的稀硝酸通过_________________________________________方法变成浓硝酸。
(3)为了除去铝土矿中少量Fe2O3和SiO2等杂质制得纯净的,操作过程如下图:
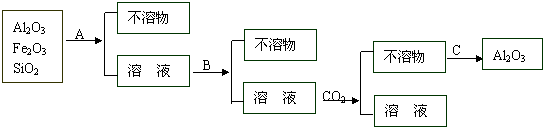
①、操作过程中的试剂或方法:A是 ,B是 ,C是 。
②、在溶液中加入B后发生反应的离子方程式为 , ,在溶液中通入过量CO2后发生反应的离子方程式为 。
③、如果A、B互换,则通CO2应改加 。
19.为测定某一铁矿石样品中的铁元素的质量分数, 取3.702g该铁矿石(铁以Fe2O3形式存在,其余物质不含铁)溶于浓热盐酸中,稀释至250mL,从中取出25mL溶液,作如下处理:加入过量的氨水,使铁以氢氧化铁的形式沉淀,将沉淀过滤,洗净并灼烧,使之完全转化为氧化铁。有关实验数据:
坩埚质量:15.2861g
第一次灼烧后坩埚和固体的质量:15.6209g
第二次灼烧后坩埚和固体的质量:15.6205g
第三次灼烧后坩埚和固体的质量:15.6205g
则铁矿石中的铁元素的质量分数为
A.63.2% B.90.3% C.6.32% D.34.4%
第Ⅱ卷(共83分)
18、某白色固体可能由①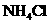 ②
② ③NaCl ④
③NaCl ④ ⑤KOH中的一种或几种组成,此固体投入水中得澄清溶液,该溶液可使酚酞呈红色,若向溶液中加稀硝酸到过量,有白色沉淀生成.对原固体的判断不正确的是
⑤KOH中的一种或几种组成,此固体投入水中得澄清溶液,该溶液可使酚酞呈红色,若向溶液中加稀硝酸到过量,有白色沉淀生成.对原固体的判断不正确的是
A.肯定存在① B.至少存在②和⑤
C.无法确定是否有③ D.至少存在①、④、⑤
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com