
题目列表(包括答案和解析)
1.碱金属与卤素所形成的化合物大都具有的性质是:①高沸点 ②能溶于水 ③水溶液能导电 ④低熔点 ⑤熔融状态不导电
A.①②③ B.③④⑤ C.①④⑤ D.②③⑤
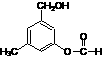
27.(10分)某有机物A的结构简式为:
⑴某同学对其可能具有的化学性质进行了如下预测,其中错误的是 。
①可以使酸性高锰酸钾溶液褪色;
②可以和NaOH溶液反应;
③在一定条件下可以和乙酸发生反应;
④在一定条件下可以发生消去反应;
⑤在一定条件下可以和新制Cu(OH)2反应;
⑥遇FeCl3溶液可以发生显色反应。
⑵该有机物的同分异构体甚多,其中有一类可以用 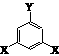 通式表示(其中X、Y均不为氢),试写出其中符合上述通式且能发生银镜反应的四种物质的结构简式:
通式表示(其中X、Y均不为氢),试写出其中符合上述通式且能发生银镜反应的四种物质的结构简式:
, , , 。
26.(12分)法国化学家V.Grignard,所发明的Grignard试剂(卤代烃基镁)广泛运用于有机合成。Grignard试剂的合成方法是:RX+Mg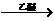 RMgX(Grignard试剂)。生成的卤代烃基镁与具有羰基结构的化合物(醛、酮等)发生反应,再水解就能合成各种指定结构的醇:
RMgX(Grignard试剂)。生成的卤代烃基镁与具有羰基结构的化合物(醛、酮等)发生反应,再水解就能合成各种指定结构的醇:
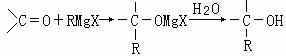
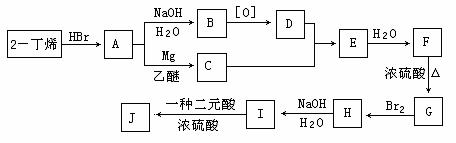
现以2-丁烯和必要的无机物为原料合成3,4-二甲基-3-己醇,进而合成一种分子式为C10H16O4的具有六元环的物质J,合成线路如下,H的一氯代物只有3种。
请按要求填空:
⑴F的结构简式是 ;
⑵C+D→E的反应类型是 ,F→G的反应类型是 ;
⑶写出下列化学反应方程式(有机物请用结构简式表示):
A→B ,
I→J 。
 ⑷I和该二元酸除了能反应生成J外,还可以在一定条件下发生缩聚反应生成高聚物,试写出此高聚物的结构简式
。
⑷I和该二元酸除了能反应生成J外,还可以在一定条件下发生缩聚反应生成高聚物,试写出此高聚物的结构简式
。
25.(13分)亚氯酸钠(NaClO2)是一种重要的含氯消毒剂,主要用于水的消毒以及砂糖、油脂的漂白与杀菌。以下是过氧化氢法生产亚氯酸钠的工艺流程图:
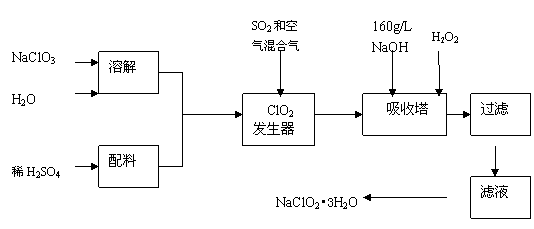

已知:①NaClO2的溶解度随温度升高而增大,适当条件下可结晶析出NaClO2•3H2O。②纯ClO2易分解爆炸,一般用稀有气体或空气稀释到10%以下安全。
⑴160 g/L NaOH溶液的物质的量浓度为 。若要计算该溶液的质量分数,还需要的一个条件是 (用文字说明)。
⑵发生器中鼓入空气的作用可能是 (选填序号)。
(a)将SO2氧化成SO3,增强酸性;(b)稀释ClO2以防止爆炸;(c)将NaClO3氧化成ClO2
⑶吸收塔内的反应的化学方程式为 。
吸收塔的温度不能超过20℃,其目的是防止H2O2分解,写出H2O2分解的化学方程式:
。
⑷在碱性溶液中NaClO2比较稳定,所以吸收塔中应维持NaOH稍过量,判断NaOH是
否过量的简单实验方法是 。
⑸吸收塔中为防止NaClO2被还原成NaCl,所用还原剂的还原性应适中。除H2O2外,还可以选择的还原剂是 (选填序号)。
(a) Na2O2 (b) Na2S (c)FeCl2 (d)PbO(悬浊液)
⑹从滤液中得到NaClO2•3H2O粗晶体的实验操作依次是 (选填序号)。
A.蒸馏 B.蒸发 C.灼烧 D.过滤 E.冷却结晶
要得到更纯的NaClO2•3H2O晶体必须进行的操作是 (填操作名称)。
24.(8分)下表是元素周期表的前三周期,用相应的化学用语回答下列问题:
|
|
|
|
||||||
|
a |
|
|
|
b |
c |
d |
e |
|
|
f |
|
g |
|
|
h |
|
|
⑴g的单质能与f元素的最高价氧化物对应的水化物的溶液反应,请写出该反应的离子方程式 。
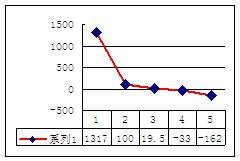
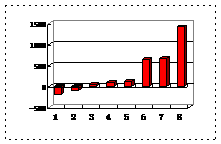
⑵第三周期8种元素按单质熔点(℃)大小顺序的柱形图(上左图),其中序号“2”代表 ,“8”代表 。
⑶a、b、c、d、e的氢化物的沸点直角坐标图(上右图),序号“5”氢化物的化学式为 ,序号“1”的氢化物的电子式: 。
⑷电子排布式为[Ne] 3S23P4的元素名称为: ;其氢化物的空间构型为: 。
23.(7分)某化学兴趣小组,专门研究了氧族元素及其某些化合物的部分性质。所查资料如下:
⑴碲(Te)为固体,H2Te为气体,Te和H2不能直接化合生成H2Te
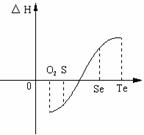 ⑵等物质的量氧气、硫、硒、碲与H2反应的焓变
⑵等物质的量氧气、硫、硒、碲与H2反应的焓变
情况如图所示:
请回答下列问题:
⑴H2与硫化合的反应 热量(填“放
出”或“吸收”)。
⑵已知H2Te分解反应为熵增反应,请解释为什么Te和H2的反应不能自发发生 。
⑶在容积均为1 L(容器体积不可变)的甲、乙两个容器中,分别加入2 mol SO2、1 mol O2 和4 mol SO2、2 mol O2,在相同温度、催化剂下使其反应。最终达到平衡后,两容器中SO2转化率分别为α甲、α乙,甲容器中平衡常数表达式为 (用含α甲的代数式表示),此时α甲 α乙(填“大于”、“小于”或“等于”)。
22.(18分)有一包含有碳酸钠杂质的碳酸氢钠样品。为了测定其纯度,某校课外学习小组在实验室做如下实验:
⑴第一组同学称取样品m1 g置于坩埚中加热至恒重,根据质量减少来计算其纯度。
①为完成测定,以下图示中还缺少的仪器名称是_ 。


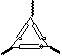




②为了减小实验误差,在加热至恒重的过程中应如何操作?
。
③若坩埚质量为m0 g,恒重后坩埚和残留物质量为m2 g,则计算碳酸氢钠样品纯度的计算式为w(NaHCO3)% = ×100% 。
⑵第二组同学称取样品m g,设计了如下图所示的装置:
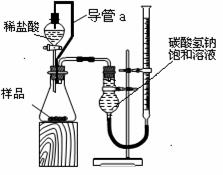
①装置中导管a的作用是 。
②实验结束时,该组同学在测量实验中生成气体体积时应注意哪些问题?
③第二组同学在实验中准确测得3个数据:实验前样品的质量m g,实验前后碱式滴定管中液面读数分别为V1 mL、V2 mL,由此欲计算碳酸氢钠样品纯度时发现少了一个必须的物理量是 。
⑶分析上述两组实验方案,你认为哪组实验方案的误差会小些?为什么?
⑷请你设计一种除上述实验原理以外的方案,写出反应方程式并简述实验步骤。
21.(12分)某研究性学习小组在做氯气的喷泉实验时(装置如图),发现含有酚酞的NaOH溶液喷入烧瓶后,溶液的红色褪去。甲、乙两位同学对此现象分别做了如下推测:
甲:因为氯气与NaOH溶液反应,使溶液碱性减弱甚至呈酸性,所以溶液红色褪去。
乙:因为氯气溶于水并与水反应生成HClO,由于HClO的氧化漂白作用而使溶液褪色。
⑴验证甲同学的推测是否正确的方法是: 。
验证乙同学的推测是否正确的方法是: 。
⑵如果将NaOH溶液改成酸性KMnO4溶液,把Cl2换成SO2气体,试问用图示所给装置完成喷泉实验是否合理?________________(填“合理”或“不合理”)。如果认为不合理,请说明你的理由__________________________________________。
⑶类似“褪色喷泉实验”还有多种“变色的喷泉实验”,请你按实验要求,分别设计1个“变色喷泉实验”并填写下列表格:
|
编号 |
实验要求 |
烧杯中的溶液 |
滴管中的液体 |
烧瓶中的气体 |
|
① |
无色变红色喷泉 |
|
H2O |
|
|
② |
红色变无色喷泉 |
|
|
SO2 |
20.绿色化学己成为当前化学研究的热点和前沿,旨在从源头上消除污染,实现经济和社会可持续发展。而常温离子液体(ionic liquid)(也有称常温熔融盐)以其优异的理化特性最有可能使上述理想变为现实。1914年报道的第一种离子液体硝酸乙基铵((C2H5NH3)NO3)离子液体其熔点为12℃。已知C2H5NH2结合质子的能力比NH3略强,下列有关硝酸乙基铵的说法正确的是
A.离子液体可以作为电池的电解质
B.硝酸乙基铵水溶液呈碱性
C.硝酸乙基铵水解的离子方程式或表示为:C2H5NH3++H2O=C2H5NH2+H3O+
D.相同温度下,相同物质的量浓度的硝酸乙基铵溶液和硝酸铵溶液前者的pH值小
19.将含有杂质的4.0g NaOH配成1000mL溶液,取20mL置于锥形瓶中,用0.1mol/L的盐酸滴定。用甲基橙作指示剂,滴定达终点时,耗酸19.0mL,则NaOH中含有的杂质不可能为
A.NaCl B.Na2CO3 C.NaHCO3 D.Ca(OH)2
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com