
题目列表(包括答案和解析)
5.在标况下,将CO2和CO混和气体(密度为10/7g·L-1)充满一盛有足量的Na2O2的密闭容器中(容积为22.4L,固体体积忽略不计)用不间断的电火花引发至充分反应,下列对完全反应后容器里残留物的叙述正确的是
A.有0.125mol O2 B.有0.5mol O2
C.有0.5mol CO D.有0.25mol Na2CO3
4.用含H37Cl的溶液跟K35ClO3晶体在一定条件下充分反应后,生成氯气、氯化钾和水:此反应生成氯气的式量为
A.72 B.73 C.73.33 D.70.6
3.很多物质的名称中含有水,“水”通常有三种含义:①表示水这种物质;②表示水溶液;③表示物质处于液态。下列物质名称中的“水”不是以上三种含义的是
A.重水 B.溴水 C.水银 D.水晶
2.磁流体是电子材料的新秀,它既具有同体的磁性,又具有液体的流动性。制备时将含等物质的量的FeSO4和Fe2(SO4)3的溶液混合,再滴入稍过量的氢氧化钠溶液,随后加入油酸钠溶液,即可生成黑色的、分散质粒子的直径在5.5nm-36nm的磁流体。下列说法中正确的是
A.所得的分散系属于悬浊液 B.所得的分散系中的分散质为Fe2O3
C.给分散系通电时阳极周围黑色加深 D.该分散系能产生丁达尔效应
1.2004年,美国科学家通过“勇气”号太空车探测出水星大气中含有一种称为硫化羰(化学式为COS,羰音tang)的物质,己知硫化羰的结构与二氧化碳相似,但能在氧气中完全燃烧,下列有关硫化羰的说法中正确的是
A.硫化羰是酸性氧化物
B.硫化羰是由极性键构成的非极性分子
C.硫化羰可用做灭火剂
D.硫化羰在氧气中完全燃烧后的生成物是CO2和SO2
25.(10分)工业上为了处理含有Cr2O72-的酸性工业废水,采用下面的处理方法:往工业废水中加入适量的NaCl,以Fe为电极进行电解,控制一定条件,仅使Fe3+、Cr3+转化为沉淀,使废水中的铬含量达排放标准。现有1 L含有Cr2O72-的酸性工业废水,用上述方法处理后,在阴极上得到0.896 L(标准状况)气体,生成4.24 g 沉淀。
(1) Cr2O72-在酸性条件下与Fe2+ 发生氧化还原反应,生成Cr3+和Fe3+ 。写出该氧化还原反应的离子方程式 ▲ 。
(2)通过计算,确定处理后的废水中是否存在Cr2O72-。
24.(8分)合成氨的原料气N2和H2通常是以焦炭、水和空气为原料来制取的。造气的主要反应为:①2C+O2==2CO;②C+H2O(g)==CO+H2 。
(1) 1200 g 焦炭按①、②式完全反应时,生成标准状况下气体的体积V的范围
▲ m3。
(2) 现将焦炭、H2O(g)和空气混合完全反应,使生成的混合气体中[n(CO)+n(H2)]/ n(N2) =3,则混合气体中空气和H2O(g)的体积比为 ▲ (设空气中N2和O2的体积比为4∶1)。
(3) 为满足合成氨原料气的要求,使[n(CO)+n(H2)]/ n(N2) =3,且n(N2)/n(H2)=1,工业上采用焦炭与富氧空气和H2O(g)同时反应,则该富氧空气中O2的体积分数为多少?(假设某富氧空气仍只含O2和N2)
23.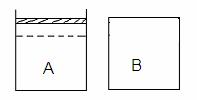 (10分)如右下图所示两个等体积的容器,A为恒压容器,B为恒容容器。在相同温度下,分别将1 mol N2 和3 mol H2 混合气体充入A、B容器中,发生如下反应:
(10分)如右下图所示两个等体积的容器,A为恒压容器,B为恒容容器。在相同温度下,分别将1 mol N2 和3 mol H2 混合气体充入A、B容器中,发生如下反应:
 N2(g)+3 H2
(g) 2NH3
(g); △H=-92.4 kJ/mol 。
N2(g)+3 H2
(g) 2NH3
(g); △H=-92.4 kJ/mol 。
保持温度不变,A、B容器中的反应均达到平衡状态。平衡时,A容器中气体体积为起始时的4/5,平衡状态记为P。
试回答下列问题:
(1) 平衡时A容器中NH3 的体积分数是 ▲ 。若要使B容器中NH3 的体积分数与 A容器中相同,可采取的措施是 ▲ 。
(2) 若保持温度不变,向B容器中补加c mol NH3 ,再次达到平衡时,A、B两容器中压强恰好相等,则c= ▲ 。
(3)若保持温度不变,开始时向容器A中加入a mol N2 、b mol H2和c mol NH3 ,要使反应向逆反应方向进行,且达到平衡后各气体的物质的量与原A平衡状态P相同,则起始时,c的取值范围是 ▲ 。
(4)若保持温度不变,开始时向容器B中加入a mol N2 、b mol H2 和 1 mol NH3 ,平衡时,测得放出的热量为23.1 kJ,NH3 的体积分数与A容器平衡状态P相同,则a + b 的值是 ▲ 。
22.(8分) 发射航天飞机的火箭常用氮的氢化物肼(N2H4)作燃料。试回答下列有关问题:
⑴在结构上N2H4和NH3的关系有如H2O2和H2O的关系。N2H4能发生下列反应:

 N2H4 + H3O+
N2H5+ +
H2O
N2H4 + H2O N2H5+ + OH-
N2H4 + H3O+
N2H5+ +
H2O
N2H4 + H2O N2H5+ + OH-

 N2H5+
+ H2O N2H62+ + OH- N2H5+
+ H2O N2H4 + H3O+
N2H5+
+ H2O N2H62+ + OH- N2H5+
+ H2O N2H4 + H3O+
据此你可得出的结论是 ▲ (填字母)。
A.肼水解显酸性 B.肼在水中电离出H+
C.肼是二元弱碱 D.肼是二元弱酸
⑵ 液态NH3类似H2O,也能微弱电离且产生电子数相同的两种离子,则液态NH3电离方程式为 ▲ 。
⑶ 25℃时,0.2 mol·L-1 氨水与0.2 mol·L-1HCl 溶液等体积混合(忽略混合后溶液体积的变化),测得混合溶液的pH=a(a<7)。则混合溶液中由水电离出的c(H+) ▲ (填“大于”、“等于”或“小于”) 0.2 mol·L-1HCl 溶液中电离出的c(H+);混合溶液中,c(H+)-c(NH3·H2O)= ▲ (用含有a的关系式表示)。
21.(12分) 在人类社会的发展进程中,金属起着重要的作用。铝是国民经济发展的重要材料,目前我国铝消费超过430万吨,在众多的金属中仅次于钢铁。
经查阅,铝及其氧化物的有关实验数据如下:
|
|
熔点/℃ |
沸点/℃ |
燃烧热/kJ·mol-1 |
|
铝 |
660 |
2467 |
602 |
|
氧化铝 |
2050 |
2980 |
/ |
(1) 铝是地壳中含量最多的金属元素,它占地壳总质量的7.51%,比铁几乎多1倍,是铜的近千倍。但人类发现和利用铝比较迟,你认为其主要原因是 ▲ 。
(2) 用坩埚夹住一小块铝箔(箔厚约0.1mm),在酒精灯上加热至熔化,轻轻晃动,观察到的现象是:铝箔熔化,失去了光泽,熔化的铝并不滴落,好像有一层膜兜着。铝箔“卷缩不脱落”是因为 ▲ 。
(3)将铝片插入硝酸汞溶液中,铝片表面灰暗,用湿布擦试后,铝片上附着了液态银白色的物质。将该铝片静置一段时间,铝片表面长出白色须状物,手持铝片时,白色须状物脱落,铝片发烫。经实验白色须状物能溶于稀盐酸且无气体放出。试写出直接导致铝片发烫的热化学反应方程式 ▲ 。
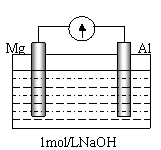 (4) 剪取大小、表面积相近的镁条和铝片,用砂纸打磨其表面,使镁条与铝片与电流计相连接后迅速插入盛有1mol/LNaOH溶液的烧杯中(如图)。预期的实验现象是:铝片溶解,镁片上有大量气泡放出。然而实验事实是:开始,铝片表面有许多气泡,随后,铝片表面气泡减少,镁条表面只有少量气泡产生,电流计显示电流方向与开始时相反。请写出后一过程镁片上的电极反应式 ▲ 。
(4) 剪取大小、表面积相近的镁条和铝片,用砂纸打磨其表面,使镁条与铝片与电流计相连接后迅速插入盛有1mol/LNaOH溶液的烧杯中(如图)。预期的实验现象是:铝片溶解,镁片上有大量气泡放出。然而实验事实是:开始,铝片表面有许多气泡,随后,铝片表面气泡减少,镁条表面只有少量气泡产生,电流计显示电流方向与开始时相反。请写出后一过程镁片上的电极反应式 ▲ 。
(5) 能源问题是人们关心的热点,有人提出用金属铝作燃料,这真是一种大胆而新颖的设想。对此,你的观点是 ▲ (填“A”或“B”),其理由是 ▲ 。
A.可行 B.不可行
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com