
题目列表(包括答案和解析)
2、一定条件下,碘单质与砹单质以等物质的量进行反应,可得AtI。它与Zn、NH3都能发生反应,化学方程式分别如下:2AtI+2Zn==ZnI2+ZnAt2 AtI+2NH3(l)==NH4I+NH2At。
下列关于AtI性质的叙述正确的是 ( )
A.ZnI2既是氧化产物,又是还原产物
B.ZnAt2既是氧化产物,又是还原产物
C.AtI与液氨反应,AtI既是氧化剂,又是还原剂
D.AtI与液氨反应,是自身氧化还原反应
1、我国科学家为一个比头发丝还细的小分子恢复了磁性,由此创造了一项“世界第一”。实验时将一种名为“钴酞菁”的小分子搬上了“手术台”。这个“个头”仅为1.3纳米的小分子,其结构和性质与人体内的血红素及植物体内的叶绿素非常相似,在光电子器件、生物技术等方面具有广泛而重要的应用与研究价值。下列说法正确的是 ( )
A.“钴酞菁”的小分子具有胶体的性质
B.纳米材料可以应用于所有化工领域
C.现在纳米器件都是无所不能的胶体
D.此工作实现了利用局域的化学反应来改变和控制分子的物理性质
23.已知C12和NO2在一定条件下可以化合成一种气态化合物A。为了测定A的组成进行如下实验:(不考虑2 NO2 N2O4的平衡)
N2O4的平衡)
(1)当C12与NO2混合气体以不同比例混合时,测得其平均式量分别为51和6l,分别求出C12在上述混合气体中的体积分数。
(2)取上述不同比例的混合气体各5L,在一定条件下充分反应后,气体体积均为4L,由此写出C12和NO2反应的化学方程式。
(3)设C12的体积分数为x(0<x<1),试讨论当x的取值范围不同时(C12与NO2的总体积为5L),反应后的总体积V随x变化的函数关系,将结果填入下表。
|
x值 |
V(反应后混合气体体积) |
|
|
|
|
|
|
|
|
|
22.(10分)
位于短周期的原子序数依次增大的D、A、B、C四种元素(其中一种是金属),它们的单质在通常情况下,A、B是固体。C2、D2是常见的双原子气体单质,另有X溶液和Y溶液。这些物质相互转化的关系如下图所示,图中G、I均为白色胶状沉淀,F是含B元素的盐。电解H的水溶液生成C2、D2和X溶液,这是一种重要的化工生产原理。

(1)X、Y的化学式分别为________、__________。
(2)l在受热灼烧后的最终产物属___________晶体。
(3)写出反应②的化学方程式:_____________________________________________。
(4)写出反应①、③的离子方程式:
反应①:________________________________________________________。
反应③:________________________________________________________。
21.(6分)
A、B、C、D均为常见的短周期元素,常温下A、B可形成两种常见的液态化合物,其最简式分别为BA和B2A、B与D可形成分子X,也可形成阳离子Y,X 和Y在水溶液中酸碱性正好相反,C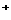 的焰色反应呈黄色。
的焰色反应呈黄色。
(1)C元素在周期表中的位置是_____________,液态X类似B2A也能微弱电离产生电子数相同的两种离子,则液态x的电离方程式:_________________________。
(2)M、N是由A、B、C、D四种元素中任意三种元素组成的不同类型的强电解质,M的水溶液呈碱性,N的水溶液呈酸性,且M溶液中水的电离程度小于N溶液中水的电离程度。则M、N分别为________________(填化学式)。若将0.1m01.L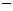 1M和0.2mol.L
1M和0.2mol.L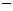 1N两溶液等体积混和所得溶液中离子浓度的大小顺序__________________________。
1N两溶液等体积混和所得溶液中离子浓度的大小顺序__________________________。
20.(10分)
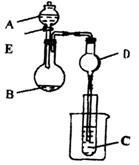
用下图装置进行实验,将A逐滴加入B中:
(1)若A为浓H2SO4,B为第三周期金属元素的片状单质,其在常温下难与水反应;C为品红溶液,实验中观察到C中溶液褪色,则B是__________________(填化学式),B与浓H2SO4反应的化学方程式为____________________。反应后往烧杯中加入沸水,又可观察到试管C中的现象为___________________。
(2)若B为KMnO4晶体,C为品红溶液,实验中观察到C中溶液褪色,则B中发生反应的化学方程式是__________________。然后往烧杯中加入沸水,试管C中的现象是______________________。
(3)若B是生石灰,实验中观察到C溶液从无色变红色,则A是____________,C是
___________仪器D在此实验中的作用是_________________________________。
19.(10分)
请按要求填空:
(1)指出下列实验用品或仪器(已经洗涤干净)使用时的第一步操作:
①石蕊试纸(检验气体性质)______________;
②容量瓶____________。
(2)当NaHCO3溶液中混有Na2CO3,为除去Na2CO3可以通入__________,化学方程式为_________________。
 (3)BaSO4中混有AgCl可通过加入__________使AgCl转化为可溶的____________除去。
(3)BaSO4中混有AgCl可通过加入__________使AgCl转化为可溶的____________除去。
18.某些盐在溶液中结晶时,析出的晶体是结晶水合物。下表记录了t°C的4份相同的硫
酸铜溶液中加入的无水硫酸铜的质量以及析出的硫酸铜晶体(CuS04·5H2O)的质量(温度维持不变)的实验数据
|
硫酸铜溶液 |
Ⅰ |
Ⅱ |
Ⅲ |
Ⅳ |
|
加入的无水硫酸铜(g) |
2.5 |
4.0 |
6.0 |
8.0 |
|
析出的硫酸铜晶体(g) |
0.10 |
2.8 |
6.4 |
10.0 |
当加入4.6g无水硫酸铜时,析出硫酸铜晶体的质量为
A.3.42g B.3.88g C.6.82g D.2.56g
17.已知HF的酸性比HCN的酸性强,现有物质的量浓度和体积相同的NaF和NaCN两种溶液,已知NaF溶液中离子数目为nl,NaCN溶液中离子数目为n2,下列关系式中正确的是( )
A.nl=n2 B.nl>n2 C.nl<n2 D.c(F-)<c(CN-)
16.某溶液中大量存在以下五种离子:NO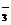 、SO2
、SO2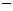 -4、Fe3+、H+、M,其物质的量之比为:n(NO
-4、Fe3+、H+、M,其物质的量之比为:n(NO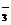 ):n(SO2
):n(SO2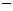 4):n(Fe3+):n(H
4):n(Fe3+):n(H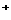 ):n(M)=2︰3︰1︰3︰1,则M可能是
):n(M)=2︰3︰1︰3︰1,则M可能是
A.Fe2+ B.Mg2+ C.Cl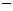 D.Ba2+
D.Ba2+
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com