
题目列表(包括答案和解析)
12、某密闭密闭容器中进行如下反应:X(g)+2Y(g)  2Z(g),若要使平衡时反应物总物质的量与生成物的物质的量相等,且用X、Y作反应物,则X、Y的初始物质的量之比的范围应满足
( )
2Z(g),若要使平衡时反应物总物质的量与生成物的物质的量相等,且用X、Y作反应物,则X、Y的初始物质的量之比的范围应满足
( )
A.1<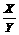 <3
B.
<3
B. <
<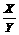 <
<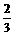 C.3<
C.3<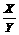 <4 D.
<4 D. <
<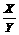 <
<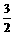
11、下列各溶液中,微粒的物质的量浓度关系正确的是 ( )
A.10mL 0.5mol/L CH3COONa溶液与6mL 1mol/L盐酸混合:
c(Cl-)>c(Na+)>c(H+)>c(OH-)
B.0.1mol/L pH为4的NaHB溶液中:c(HB-)>c(H2B)>c(B2-)
C.在NaHA溶液中一定有:c(Na+)+c(H+)=c(HA-)+c(OH-)+c(A2-)
D.c(NH4+)相等的(NH4)2SO4溶液、(NH4)2CO3溶液和NH4Cl溶液:
c[(NH4)2SO4]<c[(NH4)2CO3]<c(NH4Cl)
10、下列离子方程式书写正确的是
A、NaHSO3溶液显酸性是因为:HSO3-==SO32-+H+
B、.四氧化三铁粉末溶于足量的稀HNO3:Fe3O4+8H+=2Fe2++Fe3++4H2O
C、电解饱和食盐水时阴极电极反应式为:2H++2e-==H2↑
D、1L2mol/L的FeBr2溶液中通入2.5molCl2:2Fe2++4Br-+3Cl2==6Cl-+2Fe3++2Br2
9、设No为阿伏加德罗常数的值,下列叙述中不正确的是 ( )
A、12.4g白磷晶体中含有的P-P键数是0.6No
B、2.9g 2CaSO4·H2O含有的结晶水分子数为0.02No
C、100g的98%的浓H2SO4中所含的氧原子数为4No
D、2mol SO2和1 mol O2混合在V2O5存在的条件下于密闭容器中加热反应后,容器内物质分子数大于2No
8、某些盐在溶液中结晶时,析出的晶体是结晶水合物。下表记录了t℃的4份相同的硫酸铜溶液中加入的无水硫酸铜的质量以及析出的硫酸铜晶体(CuSO4·5H2O)的质量(温度维持不变)的实验数据:
|
硫酸铜溶液 |
① |
② |
③ |
④ |
|
加入的无水硫酸铜(g) |
2.50 |
5.00 |
8.00 |
11.0 |
|
析出的硫酸铜晶体(g) |
0.10 |
4.60 |
10.0 |
15.4 |
当加入5.60 g 无水硫酸铜时,析出硫酸铜晶体的质量为
A. 3.88 g B.5.32 C.5.68 g D.6.82 g
7、右图中a、b、c、d、e、f为元素周期表中前4周期的相邻的一部分元素,下列有关叙述正确的是
A.b、c、e三种元素的单核离子半径大小关系: e>b>c
B.六种元素中,d元素的性质最稳定
C.c的氢化物沸点比f氢化物的沸点低
D.b元素除0价外,只有一种化合价
6、合成NH3的反应N2+3H2 2NH3,起始时的混合气体的平均分子的相对质量为8.5,于一定温度和压强下,反应达到平衡后混合气体的密度比起始时增加了1/4,(设反应前后温度压强不变)则反应中N2的转化率是
( )
2NH3,起始时的混合气体的平均分子的相对质量为8.5,于一定温度和压强下,反应达到平衡后混合气体的密度比起始时增加了1/4,(设反应前后温度压强不变)则反应中N2的转化率是
( )
A.20% B.30% C.40% D.50%
|
|
|
|
|
a |
|
|
|
b |
c |
|
|
d |
e |
|
|
|
|
|
|
|
f |
|
5、在100℃时,将pH=12的NaOH溶液V1 L与pH=l的H2SO4溶液V2 L混合,若所得混合溶液的pH=11,则V1∶V2为(已知:在100℃时,水的离子积为10-12)( )
A.2:9 B.101:9 C.9:2 D.9:101
4、某同学利用中学化学教材中提供的数据或图表进行如下推理和判断,其中错误的是
A. 依据中和热的数据;推算一定量的H2SO4和NaOH的两种稀溶液反应放出的热量
B. 依据沸点的数据,判断将两种互溶的液态混合物用蒸馏方法分离开来的可能性
C. 依据相对分子质量,一定能判断组成和结构相似的物质熔沸点的高低
D.依据元素的原子结构,可以推知其在元素周期表中的位置
3、室温下,某无色透明溶液中由水电离出来的H+和OH-浓度的乘积为1×10-24,则此溶液中可能大量共存的离子组为
A.HCO3-、Al3+、Na+、SO42- B.I-、NO3-、K+、NH4+
C.MnO4-、Cl-、SO42-、K+ D.SiO32-、SO32-、Na+、Cl-
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com