
题目列表(包括答案和解析)
21、(8分)在一个固定体积的密闭容器中,向容器中充入2 mol A和1 mol B,发生如下反应:2A(g) +
B(g) 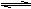 3C(g) +
D(s),反应达到平衡时C的浓度为1.2 mol/L。
3C(g) +
D(s),反应达到平衡时C的浓度为1.2 mol/L。
(1)若使容器温度升高,平衡时混合气体的平均相对摩尔质量减小,则正反应为________(填“吸热”或“放热”)反应。
(2)若维持容器体积和温度不变,按下列方法加入起始物质,达到平衡时C的浓度仍为1.2 mol/L的是_________(用序号填空)
①4 mol A+2 mol B ②3mol C+1 mol D+l mol B
③3 mol C+2 mol D ④1.6 mol A+0.8 mol B+0.6 mol C
(3)向容器中加入3 mol C和0.8 mo1 D,反应达到平衡时C的浓度仍为1.2 mol/L,则容器的容积V应大于_________L,小于________L。
(4)若设容器体积为1L,温度不变,反应从逆反应开始 (反应物只有C和D ),按不同的配比作为起始物质,达到平衡时,C的浓度仍为1.2mol/L,则D的起始物质的量应满足的条件是___________。
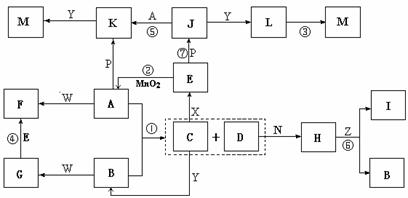
20、(8分)下图中,A为气体非金属单质,D是空气中含量最多的气体,B、E、Z为无色氢化物,其中B、E为有刺激性气味的气体,C是由三种短周期非金属元素组成的离子化合物,F、I、L为白色沉淀,其中F不溶于稀硝酸,N、P是金属单质;反应②在E的浓溶液中进行,反应⑦在E的稀溶液中进行,反应②、⑦均可用于实验室制取某种气体(图中部分反应物和生成物没有列出)。
请按要求回答:
⑴写出C的电子式 ,I的化学式 ;
⑵反应③的化学方程式为 ;
⑶反应④的离子方程式为 ;
⑷由C制取E时反应物的状态是 ,由J制取L时反应的环境是 。
19、(12分)现有下列短周期元素性质的数据:
|
元素编号 元素性质 |
① |
② |
③ |
④ |
⑤ |
⑥ |
⑦ |
⑧ |
|
原子半径(10-10m) |
0.74 |
1.60 |
1.52 |
1.10 |
0.99 |
1.86 |
0.75 |
1.43 |
|
最高或最低化合价 |
|
+2 |
+1 |
+5 |
+7 |
+1 |
+5 |
+3 |
|
–2 |
|
|
–3 |
–1 |
|
–3 |
|
试回答下列问题:
(1)上述元素中处于第VA族的有 ,处于第二周期的有 (以上均用编号表示)。
(2)上述元素中金属性最强的是 (用编号表示)。
(3) 写出元素①、⑧形成的化合物与KOH溶液反应的化学方程式 。
元素①、⑥能形成两种化合物,写出其中较稳定的化合物与水反应的化学方程式:
。
(4)经验表明,除氢和氦外,当元素原子的电子层数(n)多于或等于原子最外层电子数
(m)即(n–m)≥ 0时,该元素属于金属元素;当元素原子的最外层电子数(m)多于原子的电子层数(n)即(n–m)< 0时,该元素属于非金属元素。试回答:
a.第n(n≥ 2)周期有 种非金属元素(含零族元素)。
b.根据周期表中每个周期非金属元素的种数,预测周期表中应有 种非金属元素(含零族元素)。还有 种未发现,未发现的非金属处在第 周期第 族(注:将零族看作VIIIA族)。
甲:将锌放入浓盐酸中,反应速率较快
乙:将实验过程记录下来,并交流。

根据上述资料与交流材料回答下列列问题
⑴乙反应速率明显比甲快,原因是: 。
⑵丙、丁根据铜位于金属活动顺序表氢之后,与盐酸不反应,对乙产生的气体体积比甲大的事实。作出如下推断:
①丙认为是溶解在溶液中的H2逸出,你认为是否有道理,理由是: 。
②丁作了如下猜想,是否成立,请你设计实验方案。
|
丁猜想 |
验证方法 |
预测现象及结论 |
|
丁认为铜片中可能含有锌等杂质 |
|
|
⑶戊注意到乙中(3)中的白色沉淀,分析:不可能是CuCl2,因为CuCl2溶液显蓝色或绿色,也不可能是氯化锌,因为稀释后溶液更稀,不会析出。并利用资料①②大胆猜想,白色沉淀是生成的氯化亚铜。请你帮他设计验证方案(若有多个只设计两个方案):
|
戊 |
预计验证方法 |
预测的现象与结论 |
|
白色沉淀是氯化亚铜 |
|
|
|
|
|
⑷指导老师肯定了戊的猜想,请结合资料③,写出铜与足量浓盐酸在加热条件下反应生成无色溶液及气体,化学方程式可能是: 。
乙的实验步骤(3)稀释,生成沉淀,实际上是一个平衡问题,请写出这一平衡关系:
(用离子方程式表示)。
⑸就铜与浓盐酸反应若进一步探讨,你认为下一步实验方案: 。
18、(14分)某研究性学习小组在探究铜锌与浓盐酸反应,设计了如下实验方案
17、(10分)试完成下列两小题
(1)(4分)化学实验必须注意安全,下列做法存在安全隐患的是 (选填序号)。
A.氢气还原氧化铜实验中,先加热氧化铜后通氢气
B.蒸馏石油时,加热一段时间后发现未加碎瓷片,立刻拨开橡皮塞并投入碎瓷片
C.实验室做钠的实验时,余下的钠屑投入到废液缸中
D.配制浓硫酸与酒精混合液时,将1体积的酒精倒入3体积的浓硫酸中
E.皮肤上沾有少量浓硝酸时,立刻用大量水冲洗,再涂上稀碳酸氢钠溶液
F.制乙烯时,用量程为300℃的温度计代替量程为200℃的温度计,测反应液的温度
(2)(8分)在进行研究性学习的过程中,某同学把AgNO3溶液滴入K2HPO4溶液,即得黄色沉淀。经过查阅资料得知:K2HPO4溶液呈碱性;Ag2HPO4和Ag3PO4均为黄色沉淀,只是Ag2HPO4的颜色略浅。该同学认为不能简单地根据颜色的深浅,来确定沉淀是何物。为此,他设计了一个分析实验的方案:先测K2HPO4溶液的pH值;在K2HPO4溶液中滴加硝酸银溶液的同时,不断测定溶液的pH值,直到沉淀量达到最大为止。实际实验中,随着AgNO3溶液的滴入,溶液的pH最终为3-4之间。
① 请你判断沉淀量达到最大值时的黄色沉淀是__________________。(填“Ag3PO4”或“Ag2HPO4”)
② 根据上述实验结果,请写出K2HPO4 与AgNO3的化学方程式:
__________________________________________ ______。
③ 请你写出该实验的分析方案中是怎样得出实验结果的:
__________________________________________________________________________。
16、 甲醇是重要的基础化工原料又是一种新型的燃料,制取甲醇传统法是采用CuO-ZnO/γ- Al2O3催化剂,合成反应为:CO+2H2
CH3OH,工艺中一些参数如右
甲醇是重要的基础化工原料又是一种新型的燃料,制取甲醇传统法是采用CuO-ZnO/γ- Al2O3催化剂,合成反应为:CO+2H2
CH3OH,工艺中一些参数如右
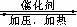
图;目前正在开发的新法是:2CH4+ O2 2CH3OH 。
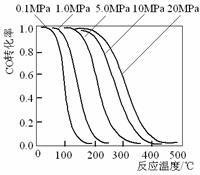 下列关于新法和旧法的说法正确的是
下列关于新法和旧法的说法正确的是
A.旧法生产中,由图知CO与H2合成甲醇的反应属
于放热反应
B.旧法生产中,选择合适催化剂时,可推测高压法
合成比低压法合成更有发展优势。
C.新法与旧法相比,原料丰富并可直接从天然气中
获得
D.新法生产中,需控制V(CH4)/V(O2)=9∶1,目的是
提高空气中氧气的转化率
第Ⅱ卷(非选择题,共86分)
15、将4.9克Mg和Fe的混合物,溶解在过量的稀HNO3溶液中,完全反应得到标况下气体2.24L,则向反应后的溶液中加入足量的烧碱,则生成沉淀的质量是 ( )
A. 6g B. 8g C. 10g D. 12g
14、今有两种正盐的稀溶液,分别是a mol/LNaX溶液和b mol/LNaY溶液,下列说法不正确的是
A.若a=b,pH(NaX) >pH(NaY),则相同浓度时,酸性HX>HY
B.若a=b,并测得c(X-)=c(Y-)+c(HY) ,则相同浓度时,酸性HX>HY
C.若a>b,测得c(X-)=c(Y-),则可推出溶液中c(HX)>c(HY),且相同浓度时,
酸性HX<HY
D.若两溶液等体积混合,测得c(X-)+c(Y-)+c(HX)+c(HY)=0.1mol/L,则可推出
a=b=0.1 mol/L
13、当向蓝色的CuSO4溶液中逐滴加入氨水时,观察到首先生成蓝色沉淀,而后沉淀又逐渐溶解成为深蓝色的溶液,向深蓝色溶液中通入SO2气体,又生成了白色沉淀:将白色沉淀加入稀硫酸中,又生成了红色粉末状固体和SO2气体,同时溶液呈蓝色,根据上述实验现象分析推测,下列描述正确的有 ( )
A.Cu2+和Ag+相似,能与NH3结合生成铜氨络离子
B.白色沉淀为+2价铜的某种亚硫酸盐,溶于H2SO4发生复分解反应
C.白色沉淀为+1价铜的某种亚硫酸盐,在酸性条件下发生了自身氧化还原反应
D.反应过程中消耗的SO2与生成的SO2的物质的量相等
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com