
题目列表(包括答案和解析)
3.下列有关晶体的说法中,正确的是( ).
A.分子晶体中一定存在共价键 B.离子晶体中不一定存在离子键
C.原子晶体的熔、沸点均较高 D.金属晶体的硬度均较大
2.下列说法正确的是( ).
A.如果5.6 L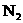 含有n个氮分子,则
含有n个氮分子,则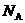 一定约为4n
一定约为4n
B.在常压、室温条件下,1 mol氦气含有的原子数为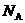
C.在100 mL 0.5 mol· 乙酸溶液中含乙酸分子数为0.05
乙酸溶液中含乙酸分子数为0.05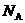
D.15.6 g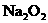 与过量
与过量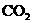 反应时,转移的电子数为0.4
反应时,转移的电子数为0.4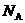
1.在含有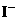 且能使酚酞变红的无色溶液中,可大量存在的离子组是( ).
且能使酚酞变红的无色溶液中,可大量存在的离子组是( ).
A.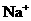 、
、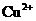 、
、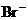 、
、 B.
B.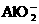 、
、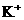 、
、 、
、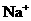
C.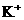 、
、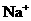 、
、 、
、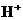 D.
D.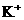 、
、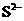 、
、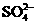 、
、
17(2分)(Ⅰ)下列实验操作或对实验事实的叙述正确的是___ ________(填序号)。①用碱式滴定管量取20.00 mL 0.10mol/L KMnO4溶液;②用托盘天平称取10.50 g干燥的NaCl固体;③各放一张质量相同的滤纸于天平的两托盘上,将NaOH固体放在左盘纸上称量;④将未经湿润的pH试纸浸到某溶液中,过一会取出与标准比色卡比较,测得该溶液的pH;⑤焰色反应操作是:将铂丝放在稀盐酸中洗涤,然后蘸取待检物置于酒精灯或煤气灯的火焰上灼烧,观察火焰的颜色;⑥中和滴定中,锥形瓶用蒸馏水洗净后可直接往其中注入一定量的待测溶液;⑦用瓷坩埚高温熔融Fe(CrO2)2和Na2CO3的固体混合物;⑧配制Al2(SO4)3溶液时,加入少量的稀硫酸。
18.(12分)在省实验调演活动中,某校几个研究性学习小组的师生对金属镁在空气中燃烧的产物进行探究。
①第一小组同学根据所学知识认为镁在空气中燃烧的产物就是氧化镁。请你用化学方程式表示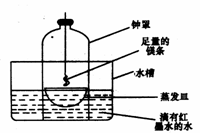 第一小组同学的观点:
;
第一小组同学的观点:
;
②第二小组同学认为,空气中存在大量的氮气,镁也可能和氮气反应。他们设计了如下装置进行实验:
镁条燃烧完后取出蒸发皿观察,发现蒸发皿中除有白色固体外还有少量的淡黄色固体。能支持第二小组同学的观点的实验现象除生成淡黄色固体外还有 ,理由是 ;
③第三小组同学对实验中生成的淡黄色固体产生了兴趣,他们向蒸发皿中的固体滴加少量水,现有刺激性气味的气体产生,淡黄色固体转变成白色。请写出上述过程中发生的化学反应方程 式: ,生成淡黄色固体的化学方程式是 ;
④第四小组同学在探究上述实验的基础上又通过查阅资料得知,Al4C3能象淡黄色固体一样,遇水也能剧烈反应。请你写出Al4C3和水反应的化学方程式 。






|
|
|
16.温度为T℃,压强为1.01×106Pa条件下,某密闭容器下列反应达到化学平衡A(g)+ B(g) 3C(?),测得此时c(A)=0.022
mol·L-1;压缩容器使压强增大到2.02×106Pa,第二次达到平衡时,测得c(A)=0.05 mol·L-1;若继续压缩容器,使压强增大到4.04×107Pa,第三次达到平衡时,测得c(A)=0.75 mol·L-1;则下列关于C物质状态的推测正确的是( )
3C(?),测得此时c(A)=0.022
mol·L-1;压缩容器使压强增大到2.02×106Pa,第二次达到平衡时,测得c(A)=0.05 mol·L-1;若继续压缩容器,使压强增大到4.04×107Pa,第三次达到平衡时,测得c(A)=0.75 mol·L-1;则下列关于C物质状态的推测正确的是( )
A.C为非气态 B.C为气态
C.第二次达到平衡时C为气态 D.第三次达到平衡时C为非气态
15.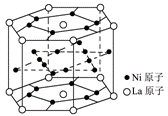 .氢气是重要而洁净的能源,要利用氢气作能源,必须安全有效地储存氢气。有报道称某种合金材料有较大的储氢容量,其晶体结构的最小单元如右图所示。则这种合金的化学式为
.氢气是重要而洁净的能源,要利用氢气作能源,必须安全有效地储存氢气。有报道称某种合金材料有较大的储氢容量,其晶体结构的最小单元如右图所示。则这种合金的化学式为
A.LaNi6 B.LaNi3
C.LaNi4 D.LaNi5
14.某无色溶液中滴入酚酞试液显红色,该溶液中可以大量共存的离子组是
A.Mg2+、Al3+、HCO3-、SO32- B.K+、Ca2+、MnO4-、Cl-
C.Ba2+、Na+、AlO2-、NO3- D.NH4+、Fe3+、SO42-、SCN-
13. 5 mL Ag+浓度为0.1 mol·L-1的某溶液,加入等物质的量的某种碱金属盐,待卤化物完全沉淀后,经过滤、干燥,称得质量为0.013 g,则此沉淀是
A.LiF B.LiCl C.AgF D.AgCl
12. A、B、C、D均是短周期元素,当A、B两元素的原子分别得到两个电子形成稳定结构时A放出的能量大于B放出的能量;当C、D两元素的原子分别失去一个电子形成稳定结构时,D吸收的能量大于C吸收的能量。若A、B、C、D四种元素间分别形成化合物时属于离子化合物可能性最大的是( )
A.C2A B.C2B C.D2A D.D2B
11.2005年9月始,“禽流感”在全球部分地区爆发,引起了人们继“非典型性肺炎”之后的世界范围内的恐慌。做好环境消毒是预防“禽流感”的重要措施,常用的消毒剂是ClO2或Cl2等的稀溶液,其中ClO2溶液的消毒效果较好。已知ClO2常温下呈气态,其分子构型与水分子的分子构型相似,在自然环境中ClO2最终变为Cl-。下列有关说法中正确的是
A.ClO2的分子结构呈V型,属非极性分子
B.ClO2中氯元素显+4价,具有很强的氧化性,其消毒效率(以单位体积得电子的数目表示)是Cl2的5倍
C.ClO2、Cl2的稀溶液用于环境消毒,具有广谱高效的特点,对人畜无任何危害
D.常用Na2SO3在H2SO4的酸性条件下,还原NaClO3来制ClO2,这一反应的化学方程式可表示为Na2SO3 + 2NaClO3 + H2SO4 = 2Na2SO4 + 2ClO2↑+ H2O
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com