
题目列表(包括答案和解析)
23.(10分)某中学有甲、乙两个探究性学习小组,他们拟用小颗粒状铝硅合金与足量稀硫酸的反应测定通常状况(约20℃,1atm)下气体摩尔体积的方法。
(1)甲组同学拟选用下列实验装置完成实验:
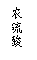
①该组同学必须选用的装置的连接顺序是A接( )( )接( )( )接( )(填接口字母,可不填满。)
②实验开始时,先打开分液漏斗上口的玻璃塞,再轻轻打开其活塞,一会儿后稀硫酸也不能顺利滴入锥形瓶。请你帮助分析原因。 。
③实验结束时,该组同学应怎样测量实验中生成氢气的体积?
___________________________________________________________________________。
 (2)乙组同学仔细分析甲组同学的实验装置后,认为:稀硫酸滴入锥形瓶中,即使不生成氢气,也会将瓶内空气排出,使所测氢气体积偏大;实验结束时,连接广口瓶和量筒的导管中有少量水存在,使所测氢气体积偏小。于是他们设计了右图所示的实验装置。
(2)乙组同学仔细分析甲组同学的实验装置后,认为:稀硫酸滴入锥形瓶中,即使不生成氢气,也会将瓶内空气排出,使所测氢气体积偏大;实验结束时,连接广口瓶和量筒的导管中有少量水存在,使所测氢气体积偏小。于是他们设计了右图所示的实验装置。
①装置中导管a的作用是 ______________________,
________________________________________________________
②实验中准确测得4个数据:实验前铝硅合金的质量m1 g,实验后残留固体的质量m2 g,实验前后碱式滴定管中液面读数分别为V1 mL、V2 mL。则通常状况时气体摩尔体积Vm=____________ L·moL-1。
22. (10分)电解法制碱的主要原料是饱和食盐水,由于粗盐水中含有泥沙、Ca2+、Mg2+、Fe3+、SO42-等杂质,不符合电解要求,因此必须经过精制。某同学设计了一种制备精盐的实验方案,步骤如下(用于沉淀的试剂稍过量):
(10分)电解法制碱的主要原料是饱和食盐水,由于粗盐水中含有泥沙、Ca2+、Mg2+、Fe3+、SO42-等杂质,不符合电解要求,因此必须经过精制。某同学设计了一种制备精盐的实验方案,步骤如下(用于沉淀的试剂稍过量):
步聚1:取一定量的粗盐,置于烧杯中,加入足量的水,配成粗盐水;
步聚2:向粗盐水中加入除杂试剂,然后进行过滤,滤去不溶
物,再向滤液中加入盐酸调节盐水的pH;
步聚3:将得到的溶液蒸发浓缩、冷却、结晶、过滤、烘干即得精盐;
请回答以下问题:
(1)上述实验中的过滤操作需要烧杯、____________、___________等玻璃仪器。
(2)步聚2中常用Na2CO3、NaOH、BaCl2作为除杂试剂,则加入除杂试剂的顺序为:______________________________________;
(3)步聚2中,判断加入BaCl2已过量的方法是:
________________________________________________;
(4)步聚2中,若先用盐酸调节pH再过滤,将会对实验结果产生影响,其原因是:
________________________________________________;
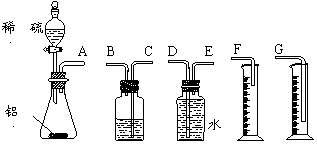
(5)为检验精盐纯度,需配制150 mL 0.2 mol/L NaCl(精盐)溶液,上图是该同学转移溶液的示意图,图中的错误是___________________、_____________________。
21.(10分)铁是人体必须的微量元素,治疗缺铁性贫血的常见方法是服用补铁药物。“速力菲”(主要成分:琥珀酸亚铁,呈暗黄色)是市场上一种常见的补铁药物。该药品不溶于水但能溶于人体中的胃酸。
 某同学为了检测“速力菲”药片中Fe2+的存在,设计并进行了如下实验:
某同学为了检测“速力菲”药片中Fe2+的存在,设计并进行了如下实验:
⑴ 试剂1是 ,试剂2是 ,加入新制氯水后溶液中发生的离子反应方程式是 , ;
⑵ 加入试剂2后溶液中颜色由淡黄色转变为淡红色的是因为 ,请你运用物质结构的知识解释Fe3+比Fe2+稳定的原因 ;
⑶ 该同学猜想血红色溶液变为无色溶液液的原因是溶液中的+3价铁被还原为+2价铁,你认为该同学的猜想合理吗? 。若你认为合理,请说明理由(若你认为不合理,该空不要作答) ;若你认为不合理请提出你的猜想并设计一个简单的实验加以验证(若你认为合理,该空不要
作答) 。
20.将一定体积的某NaOH溶液分成两等份,一份用pH=2的一元酸HA溶液中和,消耗酸溶液的体积为V1;另一份用pH=2的一元酸HB溶液中和,消耗酸溶液体积为V2,则下列叙述正确的是
A.若V1>V2,则说明HA的酸性比HB的酸性强
B.若V1>V2,则说明HA的酸性比HB的酸性弱
C.因为两种酸溶液的pH相等,故V1一定等于V2
D.若将两种酸溶液等体积混合,混合溶液的pH一定等于2
第Ⅱ卷(共80分)
19. 在0.1mol/L KAl(SO4)2溶液中,下列关系式中正确的是
A.c(H+)<c(OH-)<c(K+)<c(SO42-)
B.c(H+)<c(Al3+)<c(K+)<c(SO42-)
C.c(H+)+c(Al3+)=0.1mol/L
D.c(H+) +c(K+) +c(Al3+) =c(SO42-) +c(OH-)
18.下列有关化学实验的操作或说法中,正确的是
A.用有少量蒸馏水的锥形瓶装待测液进行中和滴定实验,对测定结果没有影响
B.在进行硫酸铜晶体里结晶水含量的测定实验中,称量操作至少要进行4次
C.苯酚中滴加少量稀溴水出现三溴苯酚白色沉淀
D.检验溴乙烷中的溴元素时,将溴乙烷和氢氧化钠溶液混合加热后,需加硫酸酸化
17. 右图是温度和压强对X + Y
右图是温度和压强对X + Y
 2Z 反应影响的示 意图。图中横坐标表示温度,纵坐标表示平衡混合气体中Z的体积分数。下列叙述正确的是
2Z 反应影响的示 意图。图中横坐标表示温度,纵坐标表示平衡混合气体中Z的体积分数。下列叙述正确的是
A.上述可逆反应的正反应为放热反应
B.X、Y、Z均为气态
C.X和Y中只有一种是气态,Z为气态
D.上述反应的逆反应的△H>0
16.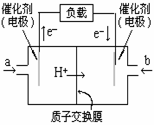 如图是2004年批量生产的笔记本电脑所用的甲醇燃料电池的结构示意图。甲醇在催化剂作用下提供质子(H+)和电子。电子经外电路、质子经内电路到达另一极与氧气反应。电池总反应式为:
如图是2004年批量生产的笔记本电脑所用的甲醇燃料电池的结构示意图。甲醇在催化剂作用下提供质子(H+)和电子。电子经外电路、质子经内电路到达另一极与氧气反应。电池总反应式为:
2CH3OH+3O2=2CO2+4H2O。
下列说法中正确的是
A.右边的电极为电池的负极,b处通入的是空气
B.左边的电极为电池的负极,a处通入的是甲醇
C.电池负极的反应式为:CH3OH+H2O-6e-=CO2+6H+
D.电池的正极反应式为:O2+2H2O+4e-=4OH-
14. 下列因果关系成立的是
A.因为金刚石中C-C键能>晶体硅中Si-Si键能,所以金刚石的熔、沸点比晶体硅高
B.因为M(I2)>M(Br2),所以分子间作用力I2>Br2,I2的化学性质比Br2稳定
C.因为NaCl晶体中存在大量的阴、阳离子,所以NaCl晶体的导电性比Na强
D.因为冰是固体,水是液体,所以冰的密度比水大
15,一定量某有机物溶解于适量的NaOH溶液中,滴入酚酞,溶液呈红色,煮沸5min后,溶液颜色变浅,再加入盐酸显酸性,沉淀出白色晶体。取少量晶体放到FeCl3溶液中,溶液呈紫色,则该有机物可能是
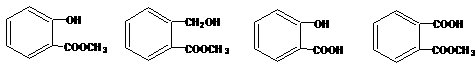
A B C D
13.下列用来表示物质变化的反应式中,错误的是
A.钢铁腐蚀时可能发生的正极反应:2H2O + O2 + 4e- = 4OH-
B.向KHSO4溶液中滴入Ba(OH)2溶液使pH=7:
SO42- + H+ + Ba2+ + OH- = BaSO↓+ H2O
C.明矾水解的离子方程式:Al3+ + 3H2O
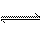 Al(OH)3 + 3H+
Al(OH)3 + 3H+
D.K37ClO3与浓盐酸(HCl)在加热时生成氯气:
K37ClO3 + 6HCl = K37Cl + 3Cl↑+ 3H2O
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com