
题目列表(包括答案和解析)
5.用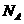 表示阿伏加德罗常数的数值,下列说法正确的是( )
表示阿伏加德罗常数的数值,下列说法正确的是( )
A.在标准状况下,VL水含有的氧原子个数为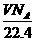
B.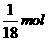 的
的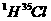 分子所含中子数为
分子所含中子数为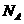
C.1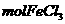 与水完全反应转化为氢氧化铁胶体后,其中胶体粒子的数目为
与水完全反应转化为氢氧化铁胶体后,其中胶体粒子的数目为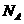
D.常温时1 L 1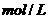 的醋酸溶液中,所含醋酸分子数为
的醋酸溶液中,所含醋酸分子数为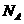
4.常见的晶体有如下类型:①分子晶体 ②离子晶体 ③原子晶体④金属晶体,在非金属元素所形成的单质或化合物中,固态时的晶体类型可以是( )
A、①②③④ B、只有①③④ C、只有①②③ D、只有①③
3.下列物质属于纯净物的是( )
A、王水 B、氯水 C、双氧水 D、冰水混合物
2.下列说法正确的是
A.乙醇和汽油都是可再生资源,应大力推广“乙醇汽油”
B.钢铁在海水中比在河水中更易腐蚀,主要原因是海水中含氧量高于河水
C.废弃的塑料、金属、纸制品及玻璃都是可回收再利用资源
D.凡含有食品添加剂的食物对人体均有害,不宜食用
1.1998年诺贝尔化学奖授予科恩(美)和波谱尔(英),以表彰他们在理论化学领域作出的重大贡献。他们的工作使实验和理论能够共同协力探讨分子体系的性质。引起整个化学领域正在经历一场革命性变化。下列说法正确的是
A.化学不再需要实验 B.未来化学的方向是经验化
C.化学不再是纯实验科学 D.化学仍然是纯实验化学
28.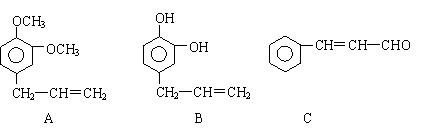 (12分) 从某些植物树叶提取的挥发油中含有下列主要成分:
(12分) 从某些植物树叶提取的挥发油中含有下列主要成分:
(1)写出A的分子式 。
(2)1molB与溴水充分反应,需消耗 mol单质溴。
(3)写出C满足下列条件的同分异构体3种:①含苯环且其环上有两个取代基
②遇FeCl3溶液发生显色反应。
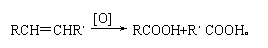 ;
;
。
;
;
。
(4)已知: 写出C在强氧化剂条件下生成
的有机化合物的结构简式 。
(5)写出A与B在一定条件下相互反应,生成高分子化合物的化学方程式:
。
27.(8分)已知烯烃中C=C双键在某些强氧化剂作用下易发生断裂,因而在有机合成中有时需要对其保护。保护的过程可简单表示如右图:
 又知卤代烃在碱性条件下易发生水解,但烯烃中双键在酸性条件下才能与水发生加成反应。
又知卤代烃在碱性条件下易发生水解,但烯烃中双键在酸性条件下才能与水发生加成反应。
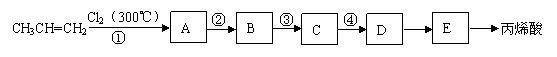 现用石油产品丙烯及必要的无机试剂合成丙烯酸,设计的合成流程如下:
现用石油产品丙烯及必要的无机试剂合成丙烯酸,设计的合成流程如下:
回答下列问题:
(1)反应①的类型为 。
(2)E的结构简式为 。
(3)反应②、④的化学方程式分别为 、 。
26. (8分)在20L恒容的密闭容器中,加入
(8分)在20L恒容的密闭容器中,加入
3mo1SO3(g和lmo1氧气,在一定温度下使其
反应,反应至4min时,氧气的浓度为0.09
mol·L-1,当反应到8min时,反应到达平衡,
此时三氧化硫浓度c(SO3)= a mol·L-1。
(1)0min-4min内生成O2平均速率
v(O2)= mol·L-1·min-1
(2)达到平衡时c(O2)=c(SO2),则a= mol·L-1,在下列坐标系中作出0min-8min及之后SO2、O2、SO3浓度随时间变化曲线.
(3)若起始时按下表数据投料,相同温度下达到平衡时,三氧化硫浓度大于a mol·L-1
的是
|
|
A |
B |
C |
D |
|
SO3 |
1mol |
3mol |
3mol |
0mol |
|
SO2 |
2mol |
1.5mol |
0mol |
6mol |
|
O2 |
2mol |
1mol |
0mol |
5mol |
25.(10分)下图是部分元素的单质及其化合物的转化关系图(有关反应的条件及部分
反应物或生成物已略去);
已知:C、D、F均为单质,其中C、D在常温、常压下是气体;反应②是化工生产中
的重要反应,生成物E具有漂白性;J、K均为不溶于水的沉淀,其中J为红褐色。
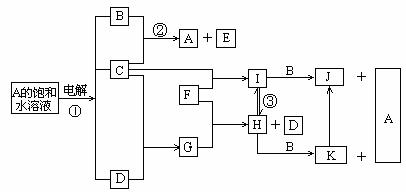
请回答下列问题:
(1)A的电子式:_______________;
(2)反应②的离子方程式是___________________________________;
(3)反应③的化学方程式是____________________________________;
(4)实验室由H制备少量K的方法:是用胶头滴管吸取B溶液,将滴管尖端插入盛有新制H溶液试管底部,慢慢挤出B溶液即可,观察到的现象为:
________________________________________________________;
(5)当有1.12L(标准状况)D生成时,反应①中转移的电子数为___________;
24.(10分) 原子形成化合物时,电子云间的相互作用对物质的结构与性质会产生影响。试
回答:
⑴ BF3分子的立体结构为 形,NF3 分子的立体结构为 形;
⑵ 碳原子有4个价电子,在有机化合物中价电子均参与成键,但杂化方式不一定相同。在乙烷、乙烯、乙炔分子中,碳原子进行sp3杂化的分子是(写结构简式) ,存在一个π键的分子是(写名称) ;
⑶ H2O、NH3、CH4分子中键角由大到小的顺序为 ,原因是 ___________________________________________________________________;
⑷ 由于电荷的作用,阴、阳离子形成化合物时离子的电子云会发生变化,使离子键逐渐向共价键过渡。阳离子电荷数越大、阴离子半径越大时,电子云变化越大,导致所形成的化合物在水中的溶解度越小。据此,四种卤化银在水中的溶解度由大到小的顺序为 。
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com