
题目列表(包括答案和解析)
24.(8分)有NH4HCO3、NH4Cl、Na2CO3·xH2O的混合物11.62g,加入44mL5mol·L-1NaOH溶液(过量),共热充分反应,让放出的气体通过碱石灰,结果收集到的气体是3.36L(标准状况)。向溶液中加入30mL2.5mol·L-1硫酸,并稍加热,使气体完全放出,收集到的气体是1.344L(标准状况)。把反应后的溶液稀释到100mL,测得溶液的pH为1。求:
(1)x值。
(2)混合物中各物质的质量。
23. (8分)已知NO2和N2O4可以相互转化:2NO2(g)
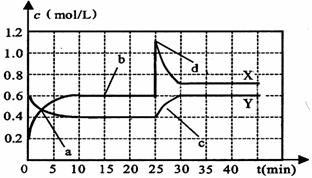
(8分)已知NO2和N2O4可以相互转化:2NO2(g)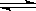 N2O4(g);△H<0。现将一定量NO2和N2O4的混合气体通入一体积为1 L的恒温密闭容器中,反应物浓度随时间变化关系如下图所示。
N2O4(g);△H<0。现将一定量NO2和N2O4的混合气体通入一体积为1 L的恒温密闭容器中,反应物浓度随时间变化关系如下图所示。
根据上图,回答下列问题:
(1)图中共有两条曲线X和Y,其中曲线 表示N2O4浓度随时间的变化;a、b、c、d四个点中,表示化学反应处于平衡状态的点是 。
(2)25 min~30 min内用NO2表示的平均化学反应速率v(NO2)= mol/(L·min);反应进行至25 min时,曲线发生变化的原因是 。
(3)若要达到与最后相同的化学平衡状态,在25 min时还可以采取的措施是 。
A、升高温度 B、缩小容器体积 C、加入催化剂 D、加入一定量的N2O4
22.(共10分)
铝和氢氧化钾都是重要的工业产品。请回答:
(1)铝与四氧化三铁发生铝热反应的化学方程式为
 (2)铝与氢氧化钾溶液反应的离子方程式是
(2)铝与氢氧化钾溶液反应的离子方程式是
(3)工业品氢氧化钾的溶液中含有某些含氧酸盐杂质,可用离子交换膜法电解提纯。
电解槽内装有阳离子交换膜(只允许阳离子通过),其工作原理如图所示。
①该电解槽的阳极反应式是____________________ 。
②通电开始后,阴极附近溶液pH会增大,其主要原因是 (填序号) .
A.阳极区的OH-移向阴极所致
B.阴极产生的金属钾与水反应生成了大量OH-
C.阴极由H2O电离出的H+放电成H2,水电离平衡移动使OH-浓度增大
③除去杂质后的氢氧化钾溶液从溶液出口_____________(填写“A”或“B”)导出。
21、(10分)工业和交通运输业的迅速发展,城市人口的高度集中,机动车数量的日益增多,人类向大气中大量排放烟尘和有害气体等,对大气造成了严重的污染。某中等城市近期一次的“空气质量日报”显示,该市的空气已受到一定程度的污染。一研究性学习小组对该市的空气污染情况进行了下列研究。
⑴小组一同学初步分析得出,该市空气污染的主要原因有:
A、使用石油液化气 B、燃烧含硫煤 C、粉尘污染
另一同学认为还有一个不可排除的原因是:D:
研究性学习小组就造成该市空气污染的最主要原因调查了该市100名市民和100位环保部门人士。调查结果如下图所示:
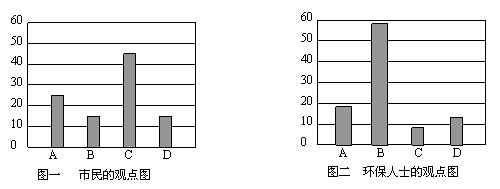 空气污染原因调查人数分布图
空气污染原因调查人数分布图
从市民和环保人士的不同观点上分析,你认为造成该市空气污染的主要有害成分是
(用化学式表示)
⑵空气污染形成酸雨。研究性学习小组对某城市的雨水进行了采样和分析,刚采集时测得PH为4.82,放在烧杯中经2小时后,再次测得PH为4.68,较长一段时间后发现PH不再变化,对此,你的合理解释是
⑶研究性学习小组取相当于标准状况下的空气1.000L(含氮气、氧气、二氧化碳、二氧化硫等),缓慢通过足量溴水,在所得溶液中加入过量的氯化钡溶液,产生白色沉淀,将沉淀洗涤,干燥,称得其质量为0.233g,进行这一实验的目的是 ,通过计算得到的结论是:空气中某有害气体的体积分数为 ;
⑷该小组提出下列措施以减少空气污染主要有害成分排放量,你认为合理的是 (填序号)
①用天然气代替煤炭作民用燃料 ②改进燃烧技术,提高煤的燃烧效率
③工厂生产时将燃煤锅炉的烟囱造得更高 ④燃煤中加入适量生灰石后使用
20.(10分)下图为一些物质间的转化关系,其中一些转化过程的条件和某些生成物已略去。已知B为无色液体,C、D、H、N……等为单质,反应③是工业上制取单质H的反应。
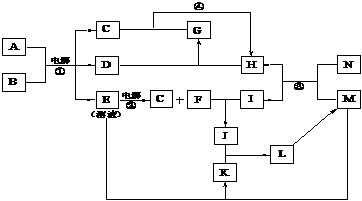
(1)写出反应③、④的化学方程式: 、
。
(2)在固态时,物质E、H、M、I、G、K中,与A的晶体类型相同的有
(写相应的化学式)。
(3)物质G的电子式为 。
(4)用离子方程式表示物质K溶液不显中性的原因 。
(5)上述物质的转化中,有一些对生产科技的发展有着重要的意义,请简单加以说明。
。
19.(8分) 元素周期表是20世纪科学技术发展的重要理论依据之一。
已知A、B、C、D、E五种元素都是元素周期表中前20号元素。A、B、C、D四种元素在课本元素周期表中的相对位置如下图所示,B、C、D的最高价氧化物的水化物两两混合,均能发生反应生成盐和水。E元素原子序数均大于A、B、C、D元素,且不与A、B、C、D元素位于同主族。
|
|
|
|
|
…… |
|
A |
|
|
|
B |
|
C |
D |
|
|
根据以上信息,回答下列问题:
(1)元素C在元素周期表中的位置是 周期 族。
(2)A和D的氢化物中,沸点较低的是 (填“A”或“D”);A和B的离子中,半径较小的是 (填离子符号)。
 (3)A和E可组成离子化合物,其晶胞(在晶体中具有代表性的最小重复单元)结构如下图所示,阳离子位于该正方体的顶点或面心;阴离子均位于小正方体中心。该化合物的电子式为
。
(3)A和E可组成离子化合物,其晶胞(在晶体中具有代表性的最小重复单元)结构如下图所示,阳离子位于该正方体的顶点或面心;阴离子均位于小正方体中心。该化合物的电子式为
。
18.(12分)铁是人体必须的微量元素,治疗缺铁性贫血的常见方法是服用补铁药物。“速力菲”(主要成分:琥珀酸亚铁,呈暗黄色)是市场上一种常见的补铁药物。该药品不溶于水但能溶 于人体中的胃酸。
某同学为了检测“速力菲”药片中Fe2+的存在,设计并进行了如下实验:

⑴ 试剂1是 ,试剂2是 ,加入新制氯水后溶液中发生的离子反应方程式是 , ;
⑵ 加入试剂2后溶液中颜色由淡黄色转变为淡红色是因为 ,
写出+2价Fe在空气中转化为+3价Fe的化学方程式 ;
⑶ 该同学猜想血红色溶液变为无色溶液的原因是溶液中的+3价铁被还原为+2价铁,你认为该同学的猜想合理吗? 。若你认为合理,请说明理由(若你认为不合理,该空不要作答) ;若你认为不合理请提出你的猜想并设计一个简单的实验加以验证(若你认为合理,该空不要作答)
。
17.Ⅰ(4分)下列有关化学实验的基本操作及安全知识的叙述,错误的是 (填序号)。
A.用托盘天平称取10.50 g干燥的NaCl固体
B.过滤时,玻璃棒靠在三层滤纸边沿稍下方,
C.测定烧杯中溶液的pH时,用pH试纸直接在烧杯中蘸取溶液
D.中和热的测定实验中,可用金属丝(棒)代替环形玻璃棒
E.配制浓硫酸和浓硝酸的混合酸时,将浓硫酸沿器壁慢慢加入到浓硝酸中,并不断搅拌
F.实验时,不慎打翻燃着的酒精灯,可立即用湿抹布盖灭火焰
G.采取降温结晶可以提纯混有少量氯化钠的硝酸钾
H.配制一定浓度的溶液时,若定容时不小心加水超过容量瓶的刻度线,应立即用滴管吸去多余的部分。
Ⅱ (6分)右图是某学校实验室从化学试剂商店买回的硫酸试剂 标签上的部分内容。某次学生实验需要0.5mol/LH2SO4溶液480ml,若由你来配制所需溶液,请根据实验室已有的仪器和药品情况回答下列问题:
(6分)右图是某学校实验室从化学试剂商店买回的硫酸试剂 标签上的部分内容。某次学生实验需要0.5mol/LH2SO4溶液480ml,若由你来配制所需溶液,请根据实验室已有的仪器和药品情况回答下列问题:
①实验中除了量筒、烧杯外还需要的其它仪器有: ;
②计算所需浓硫酸的体积是 mL;若该硫酸与等体积的水混合时,所得溶液中溶质的质量分数 49%(填写“<”、“=”或“>”);
③配制过程中需先在烧杯中将浓硫酸进行稀释。稀释时操作方法是: ;
16、 甲醇是重要的基础化工原料又是一种新型的燃料,制取甲醇传统法是采用CuO-ZnO/γ-
甲醇是重要的基础化工原料又是一种新型的燃料,制取甲醇传统法是采用CuO-ZnO/γ-
Al2O3催化剂,合成反应为:CO+2H2 CH3OH,工艺中一些参数如右
图;目前正在开发的新法是:2CH4+ O2 2CH3OH 。
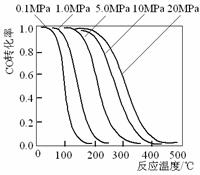 下列关于新法和旧法的说法正确的是
下列关于新法和旧法的说法正确的是
A.旧法生产中,由图知CO与H2合成甲醇的反应属
于放热反应
B.旧法生产中,选择合适催化剂时,可推测高压法
合成比低压法合成更有发展优势。
C.新法与旧法相比,原料丰富并可直接从天然气中
获得
D.新法生产中,需控制V(CH4)/V(O2)=9∶1,目的是
提高空气中氧气的转化率
第II卷(非选择题,共86分)
15.某溶液中只有Na+、CH3COO-、H+、OH-四种离子,且浓度大小的顺序为:
c(Na+)>c(CH3COO-)>c(0H-)>c(H+),该溶液可能是
A.由pH=l的CH3COOH溶液与pH=13的NaOH溶液等体积混合而成
B.由1 mL0.1 mol·L-1的CH3COOH溶液与10 mL 1 mol·L-1的NaOH溶液混合而成
C.由0.1mol·L-1的CH3COOH溶液与0.1 mol·L-1的NaOH溶液等体积混合而成
D.由0.1 mol·L-1的CH3COONa溶液与0.1 mol·L-1的NaOH溶液等体积混合而成
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com