
题目列表(包括答案和解析)
20.(10分)工业制纯碱,是向饱和食盐水中通入氨气和二氧化碳,获得碳酸氢钠晶体,它的反应原理可用下列化学方程式表示:
NH3+CO2+H2O=NH4HCO3 NH4HCO3+NaCl(饱和)=NaHCO3↓+NH4Cl
将所得碳酸氢钠晶体加热分解后即得到纯碱。请回答:
(1)工业所制得纯碱中常含有少量的氯化钠杂质,其原因是
。
(2)现有甲、乙、丙三个小组的的同学,欲测定某工业纯碱中碳酸钠的质量分数,分别设计并完成的实验如此下:
甲组:取10.00g样品,利用下图所示装置,测出反应后装置C中碱石灰的增重胃3.52g。
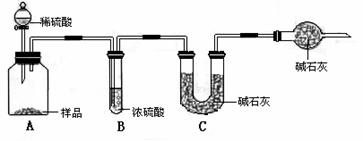
乙组:取10.00g样品,配成1000mL溶液,用碱式滴定管量取25.00mL放入锥形瓶中,加入甲基橙作指示剂,用0.150mol·L-1的标准盐酸溶液滴定至终点(有关反应为Na2CO3+2HCl=2CaCl+H2O+CO2↑)。完成三次平行实验后,消耗盐酸体积的平均值为30.00mL。
丙组:取10.00g样品,向其中加入过量的盐酸,直至样品中无气泡冒出,加热蒸发所得物并在干燥器中冷却至室温后称量。反复加热、冷却、称量,直至所称量的固体质量几乎不变为止,此时所得固体的质量为10.99g。
请分析、计算后填表:
|
分析与 计算分组 |
计算样品中碳酸钠 的质量分数 |
对实验结果 的评价 |
实验失败的主要原因 及对结果的影响 |
|
甲组 |
|
失败 |
|
|
乙组 |
|
成功 |
 |
|
丙组 |
|
成功 |
 |
19.(9分)碳酸钙可以降低胃酸的浓度而被用作胃药的治酸剂,某中学研究性学习小组胃测定一胃药中碳酸钙的质量分数,设计了如下的实验操作:
①配置0.1mol•L-1的HCl溶液和0.1mol•L-1的NaOH溶液各100mL
②取一粒(药片质量均相同)0.2g的此胃药骗,磨碎后加入20.0mL蒸馏水
③以酚酞为指示剂,用0.1mol•L-1的NaOH溶液滴定,用去VmL达到滴定终点
④加入25mL0.1mol•L-1的HCl溶液
(1)请写出正确的实验操作顺序(用编号表示) 。
(2)在下面所示的仪器中配置0.1mol•L-1的HCl溶液和0.1mol•L-1的NaOH溶液0.1mol•L-1的NaOH溶液肯定不需要的仪器是(填序号) ,配制上述溶液还需要的玻璃仪器是(填仪器的名称) 。
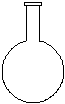
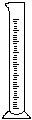
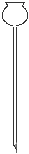

A B C D E F G
(3)写出步骤④中发生的有关反应的离子方程式
(4)每粒该胃药中含碳酸钙的质量分数
18.“绿色化学”是21世纪化学发展的主导方向,“绿色化学”要求从根本上消除污染,是一门能彻底阻止污染产生的科学。它包括“原料的绿色化”、“化学反应的绿色化”、“产物的绿色化”等内容,其中(化学反应绿色化)要求原料物质中所有的原子完全被利用且全部转入期望的产品中。下列符合“化学反应绿色化”的是
A. 2
C2 H4+ O2 2 C2
H4O
2 C2
H4O
B.实验室里制取CO2:CaCO3+2HCl=CaCl2+CO2↑+H2O
C.2M+N=2P+2Q,2P+M=Q(M、N为原料,Q为期望产品)
D.以铁屑、氧化铜、稀硫酸为原料制取铜:
CuO+H2SO4=CuSO4+H2O,Fe+CuSO4=FeSO4+Cu
|
|
化 学 试 题
第Ⅱ卷(非选择题 共78分)
可能用到的相对原子质量:H 1 C 12 O 16 Na 23 Cl 35.5 K 39 Ca 40 Mn 55
17.氮化铝(AlN)具有耐高温、抗冲击、导热性好等优良性质,被广泛应用于电子工业、陶瓷工业等领域。在一定条件下,氮化铝可通过如下反应合成
Al2O3+N2+3C 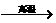 2 AlN+3CO 。下列叙述正确的是
2 AlN+3CO 。下列叙述正确的是
A.在氮化铝的合成反应中,N2 是还原剂,Al2O3 是氧化剂
B.上述反应中每生成2mol AlN ,N2 得到3mol电子
C.氮化铝中氮元素的化合价为-3
D.AlN易溶于水
16.下列离子方程式书写正确的是
A.实验室里用浓盐酸和二氧化锰加热反应制取氯气
△
MnO2+4H++2Cl_=Mn2++Cl2↑+2H2O
B.向1L2mol•L-1FeBr2溶液中通入1molCl2:
2Fe2++Cl2=2Fe3++2Cl-
C.向氢氧化钡溶液中加入过量的硫酸氢钠溶液
Ba2++OH-+H++SO42-=BaSO4↓+H2O
D.实验室里用氯化铵与熟石灰加热反应制少量氨气:
△
NH4++OH-=NH3↑+H2O
15.下列各种环境下的离子组能大量共存的是
A.pH=1的溶液中:K+、Fe2+、Cl-、NO3-
B.强碱性溶液中:Na+、K+、[Al(OH)4]-、CO32-
C.中性溶液中:Na+、Ca2+、Cl-、SO42-
D.使蓝色石蕊试液变红的溶液中:SO32-、HCO3-、Na+、K+
14.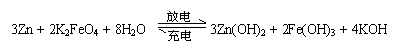 高铁电池是一种新型可充电电池,与普通高能电池相比,该电池能长时间保持稳定的放电电压。高铁电池的
高铁电池是一种新型可充电电池,与普通高能电池相比,该电池能长时间保持稳定的放电电压。高铁电池的
总反应为
下列叙述不正确的是
A.放电时负极反应为:Zn-2e- +2OH-= Zn(OH)2
B.充电时阳极反应为:Fe(OH)3
-3e- + 5 OH- = FeO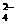 + 4H2O
+ 4H2O
D.放电时正极附近溶液的碱性增强
C.放电时每转移3 mol电子,正极有1mol K2FeO4被氧化
13.
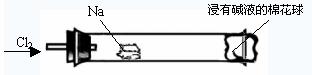 某化学教师为“氯气与金属钠反应”设计了如下装置与操作以替代相关的课本实验。实验操作:钠与氯气反应的装置可作如图改进,将一根玻璃管与氯气发生器相连,玻璃管内放一块黄豆粒大的金属钠(已吸净煤油),玻璃管尾部塞一团浸有NaOH溶液的棉花球。先给钠预热,到钠熔融成小球时,撤火,通入氯气,即可见钠着火燃烧,生成大量白烟。以下叙述错误的是
某化学教师为“氯气与金属钠反应”设计了如下装置与操作以替代相关的课本实验。实验操作:钠与氯气反应的装置可作如图改进,将一根玻璃管与氯气发生器相连,玻璃管内放一块黄豆粒大的金属钠(已吸净煤油),玻璃管尾部塞一团浸有NaOH溶液的棉花球。先给钠预热,到钠熔融成小球时,撤火,通入氯气,即可见钠着火燃烧,生成大量白烟。以下叙述错误的是
A.反应生成的大量白烟是氯化钠晶体
B.浸有NaOH溶液的棉球用于吸收未反应的氯气,以免污染空气
C .用淀粉碘化钾溶液滴在管外的棉球,可以判断氯气是否被完全吸收
D.钠着火燃烧产生苍白色火焰
12.家庭中常用石灰水保存鲜蛋,下列对石灰水保存鲜蛋得原理叙述正确得是
A.石灰水具有较强得碱性,杀菌能力强
B.石灰水是电解质溶液,能使蛋白质聚沉
C.石灰水能渗入蛋内中和酸性物质
D.Ca(OH)2能与鲜蛋呼出得CO2反应生成CaCO3薄膜
11.氯气通入石灰乳中可制得漂白粉,其有效成分为Ca(ClO)2与盐酸可发生如下反应:
Ca(ClO)2+4HCl(浓)=CaCl2+2Cl2↑+2H2O储存过久得漂白粉与浓盐酸反应制得得氯气中,除水外可能含有得杂质气体是
A.O2 B.CO2 C.HCl D.H2
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com