
题目列表(包括答案和解析)
23、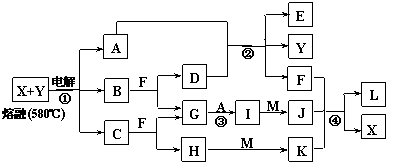 (12分)下图表示各物质之间的转化关系,其中A、B、C、G为单质。②为工业生产中常见反应,E是一种具有漂白作用的盐,Y易潮解,M是一种两性化合物,L是一种白色沉淀。
(12分)下图表示各物质之间的转化关系,其中A、B、C、G为单质。②为工业生产中常见反应,E是一种具有漂白作用的盐,Y易潮解,M是一种两性化合物,L是一种白色沉淀。
试回答下列有关问题:
⑴M的化学式 ,Y在实验室中的用途 (列举一例)。
⑵X的熔点为801℃,实际工业冶炼中常常加入一定量的Y共熔,猜想工业上这样做的目的: 。工业生产中,还常常利用电解X和F的混合物制取 。
⑶反应②的化学方程式是___________________________________________________。
⑷反应④的离子反应方程式是 。
22、(8分)A、B、C、D、E 5瓶透明溶液,分别是HCl、BaCl2、NaHSO4、Na2CO3和AgNO3中的一种。已知:
①A与B反应有气体生成 ②B与C反应有沉淀生成
③C与D反应有沉淀生成 ④D与E反应有沉淀生成
⑤A与E反应有气体生成 ⑥在②和③的反应中生成的沉淀是同一种物质
请填空:
(1)在②和③的反应中,生成的沉淀物质的化学式(分子式)是 。
(2)A是 ,B是 ,C是 ,D是 ,E是 。
(3)A与E反应的离子方程式是 。
21、(10分)下表是元素周期表中短周期元素的一部分,表中所列字母分别代表一种元素。
|
a |
|
|
|
|
|
|
b |
|
|
|
|
d |
e |
f |
|
|
|
c |
|
|
g |
|
|
h |
|
(1)上述元素的单质中熔点最高的可能是 (填字母)。
(2)在一定条件下,a与e可形成一种极易溶于水的气态化合物,其电子式为 。
(3)现有另一种元素,其原子获得一个电子所释放出能量比上表中所列元素都大,则X是周期表中_________族元素。
(4)“神舟”六号载人飞船内需要有一种化合物来吸收航天员呼出的CO2,你认为该物质应该是由上表中的_______(填字母)元素组成的,用电子式表示该物质的形成_____________________________________________。飞船中需要制造一种适合航天员生存的人工态环境,还应该在氧气中充入一种稀释气体,该气体分子式为________。另在运送飞船的火箭推进器中盛有分别由ae和af元素组成的两种液态化合物,它们的分子皆为18电子微粒,当它们混合反应时即产生e的单质和a2f。请写出该反应的化学方程式为____________________________。这个反应应用于火箭推进器,除释放大量的热和快速产生大量气体外,还有一个很大的优点是_______________________________________________________________。
20、(6分)铜与一定浓度硝酸反应时,可将方程式表示为:
Cu+HNO3---Cu(NO3)2+NO↑+NO2↑+H2O(未配平)
(1)硝酸在该反应中的作用是 。
(2)0.3mol Cu被硝酸完全溶解,如果得到的NO和NO2物质的量相同,则参加反应的硝酸的物质的量是 ,若用排水法收集这些气体,可得标准状况下的气体体积 。
(3)如果参加反应的Cu和HNO3的物质的量之比是5:14,写出并配平该反应的离子方程式_______________________________________________。
19、(12分) 将化学知识的系统化,有助于对化学问题的进一步认识。请你参与下列关于化学反应的讨论。
 问题1:从不同的角度,化学反应可以有不同的分类方法。四种基本反应类型是从物质的组成和性质进行的分类,氧化还原反应和离子反应则是从其他不同的角度进行分类的。请在右图的方框中,用图示的方法表示离子反应、化合反应和氧化还原反应之间的关系。
问题1:从不同的角度,化学反应可以有不同的分类方法。四种基本反应类型是从物质的组成和性质进行的分类,氧化还原反应和离子反应则是从其他不同的角度进行分类的。请在右图的方框中,用图示的方法表示离子反应、化合反应和氧化还原反应之间的关系。
问题2:不同化学反应进行的快慢和程度千差万别。反应的快慢和程度是化工生产考虑的两个重要因素。请你按照表中要求完成下表(填写内容不能重复)。
|
序号 |
实际生产中采取的措施 |
工业生产实例(写名称) |
|
(1) |
通过增大压强提高原料转化率 |
|
|
(2) |
使用催化剂增大反应的速率 |
|
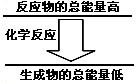 问题3:化学反应中均伴随着能量的变化。如果一个化学
问题3:化学反应中均伴随着能量的变化。如果一个化学
反应中,反应物的总能量和生成物的总能量有如图所示的
关系,则该反应过程中的能量变化是 。
已知热化学方程式为:
C(g) + O2(g)= CO2 (g) △H= -393.5KJ/mol
H2 (g) + 1/2O2 (g)= H2O (l) △H= -285.8KJ/mol
试通过计算说明等质量的氢气和碳燃烧时产生热量的比是 (保留1位小数)。
问题4:化学反应的发生是有条件的。反应物相同,反应的条件不同,反应的原理不同。如:4Na+O2=2Na2O 2Na+O2 Na2O2
;事实上还有许多条件可以影响化学反应的发生,请用离子反应方程式表示下列观点:反应物相同,反应物的浓度不同,
Na2O2
;事实上还有许多条件可以影响化学反应的发生,请用离子反应方程式表示下列观点:反应物相同,反应物的浓度不同,
反应的原理不同: 。
18、(11分) 利用如图所示的装置和其他必要的仪器用品,完成下列实验。
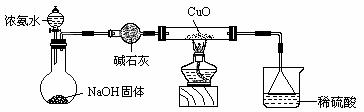
(1)证明氨气具有还原性。已知2NH3+3CuO===N2+3Cu+3H2O。
① 碱石灰的作用是 稀硫酸的作用是 。
② 浓氨水与固体NaOH接触,为什么会逸出大量氨气?
。
③ 证明NH3具有还原性的实验现象是
。
(2)用吸收了足量氨气的硫酸溶液可以制取少量硫酸亚铁铵晶体。
已知:硫酸亚铁铵是淡蓝绿色晶体,在空气中性质比较稳定。硫酸亚铁铵在水中的溶解度小于硫酸铵、硫酸亚铁。制备硫酸亚铁铵的化学方程式为:
(NH4)2SO4+FeSO4+6H2O===(NH4)2Fe(SO4)2•6H2O。
在烧杯中的溶液中加入稀H2SO4调节溶液至酸性;加入适量的硫酸亚铁浓溶液后,搅拌。为分离出硫酸亚铁铵晶体,还需要进行的实验操作是: 。
17、(1)(4分)下列实验操作或对实验事实的叙述正确的是 (填序号)
① 为了提高纯锌与稀硫酸反应的速率,可向稀硫酸中滴入几滴CuSO4溶液。
② 向沸腾的NaOH稀溶液中滴加FeCl3饱和溶液,以制备Fe(OH)3胶体。
③ 使用胶头滴管的任何实验都不允许将滴管插入液面以下。
④ 为了获得胆矾晶体,可将CuSO4溶液蒸干、灼烧到质量不再发生变化时为止。
⑤ 不慎将苯酚溶液沾到皮肤上,立即用酒精清洗。
⑥ 用石英坩埚高温熔融NaOH和Na2CO3的固体混合物。
⑦ 配制浓硫酸和浓硝酸的混合酸时,将浓硫酸沿器壁慢慢加入到浓硝酸中,并不断搅拌。
⑧ 用洁净的玻璃棒蘸取浓HNO3,点在pH试纸中部以测定此浓HNO3的pH。
(2)(5分)化学实验必须注意安全,下列做法存在安全隐患的是 (选填序号)
A、氢气还原氧化铜实验中,先加热氧化铜后通氢气。
B、蒸馏石油时,加热一段时间后发现未加碎瓷片,立刻拔开橡皮塞并投入碎瓷片。
C、实验室做钠的实验时,余下的钠屑投入到废液缸中。
D、配制浓硫酸与酒精混合液时,将1体积的酒精倒入3体积的浓硫酸中。
E、皮肤上沾有少量浓硝酸时,立刻用大量水冲洗,再涂上稀碳酸氢钠溶液。
F、制乙烯时,用量程为300℃的温度计代替量程为200℃的温度计,测反应液的温度。
16、在恒温恒容的密闭容器中,发生反应3A(g)+B(g) 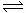 xC(g)。
xC(g)。
Ⅰ、将3molA和2molB在一定条件下反应,达平衡时C的体积分数为a;
Ⅱ、若起始时A、B、C投入的物质的量分别为n(A)、n(B)、n(C),平衡时C的体积分数也为a。
下列说法正确的是
A.若Ⅰ达平衡时,A、B、C各增加1mol,则B的转化率将一定增大
B.若向Ⅰ平衡体系中再加入3molA和2molB,C的体积分数若大于a,可断定x>4
C.若x=2,则Ⅱ体系起始物质的量应当满足3 n(B) =n(A)+3
D.若Ⅱ体系起始物质的量当满足3 n(C) +8n(A)==12 n(B)时,可断定x=4
第II卷(非选择题,共86分)
15、a mol FeS与b mol FeO投入到V L c mol•L-1的硝酸溶液中充分反应,产生NO气体,所得澄清溶液成分可看作是Fe(NO3)3、H2SO4的混合液,则反应中未被还原的硝酸可能为
A.(a+b)×63g B.(a+b)×189g C.(a+b)mol D.(Vc -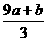 )mol
)mol
14、下列离子方程式中正确的是
A.向Fe(OH)3中加入氢溴酸: Fe(OH)3+3H+ = Fe3++3H2O
B.向NaHCO3溶液中加入过量的Ba(OH)2溶液:
Ba2++2HCO3-+2OH-= BaCO3↓+CO32-+2H2O
C.NaHS溶液水解:HS-+H2O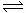 H3O++ S2-
H3O++ S2-
D.将1mol·L-1 NaAlO2溶液和1.5mol·L-1的HCl溶液等体积均匀混合:
6AlO2-+ 9H+ + 3H2O = 5Al(OH)3↓+ Al3+
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com