
题目列表(包括答案和解析)
18.元素A和B的原子序数都小于18。已知A元素原子的最外层电子数为a,次外层电子数为b;B元素原子的M电子层数为(a-b),L层电子数为(a+b),则A、B两元素所形成的化合物的性质可能有[ ]
A. 能与水反应 B.能与氢氧化钠反应 C. 能与硫酸反应 D. 不能与碳酸钠反应
17. 常温下将NaOH稀溶液与CH3COOH稀溶液混合,不可能出现的结果是[ ]
A. pH>7,且c(OH-)>c(Na+)>c(H+)>c(CH3COO-)
B. pH>7,且c(Na+)+c(H+)=c(OH-)+c(CH3COO-)
C. pH=7,且c(CH3COO-)=c(Na+)>c(H+)=c(OH-)
D. pH<7,且c(CH3COO-)>c(H+)>c(Na+)>c(OH-)
16.几种短周期元素的原子半径及主要化合价如下表:
|
元素代号 |
L |
M |
X |
R |
T |
|
原子半径/nm |
0.160 |
0.143 |
0.102 |
0.089 |
0.074 |
|
主要化合价 |
+2 |
+3 |
+6、-2 |
+2 |
-2 |
下列叙述正确的是[ ]
A. 离子半径大小:r(M3+)>r(T2-) B. R的氧化物对应的水化物可能具有两性
C. X单质可在氧气燃烧生成XO3 D. L、X形成的简单离子核外电子数相等
15. 下列反应的离子方程式正确的是[ ]
A. Fe2(SO4)3的酸性溶液中通入足量硫化氢 Fe3+ + H2S = Fe2+ + S↓+ 2H+
B. 碳酸氢钙溶液中加入过量氢氧化钠溶液 Ca2+ + HCO3-+ OH-= CaCO3↓+ H2O
C. 氯化铝溶液中加入过量氨水 Al3+ + 3OH- = Al(OH)3↓
D. 澄清石灰水中通入过量CO2 OH- + CO2 = HCO3-
14.下列各组离子 ⑴I-、ClO-、NO3-、Cl- ⑵K+、H+、NO3-、Cl-
⑶SO32-、S2-、Cl-、OH- ⑷Mg2+、Cu2+、SO42-、Cl- ⑸Fe3+、SCN-、K+、SO42-
⑹K+、HPO42-、PO43-、HSO3- 在溶液中能大量共存的组别共有[ ]
A.1组 B.2组 C.3组 D.不少于4组
13.下列溶液中,有关离子一定能大量共存的是[ ]
A.能使石蕊呈蓝色的溶液中: Na+、I-、Cl-、NO3-
B.能使甲基橙呈黄色的溶液中:K+、SO32-、SO42-、ClO-
C.能使pH试纸变红色的溶液中:Mg2+、Fe3+、NO3-、[Ag(NH3)2]+
D.能跟金属铝反应生成氢气的溶液中:NH4+、Al3+、Cl-、SO42-
12.X、Y是元素周期表ⅦA族中的两种元素。下列叙述能说明X的非金属性比Y强的是[ ]
A.X原子的电子层数比Y原子的电子层数多
B.Y的单质能将X从NaX的溶液中置换出来
C.X的单质比Y的单质更容易与氢气反应
D.同浓度下X的氢化物水溶液比Y的氢化物水溶液的酸性强
11.下列有关溶液性质的叙述,正确的是[ ]
A.室温时饱和的二氧化碳水溶液,冷却到0℃时会放出一些二氧化碳气体
B.强电解质在水中溶解度一定大于弱电解质
C.相同温度下,把水面上的空气换成相同压力的纯氧,100g水中溶入氧气的质量不变
D.将40℃的饱和硫酸铜溶液升温至50℃,或者温度仍保持在40℃并加入少量无水硫
酸铜,在这两种情况下溶液中溶质的质量分数均保持不变。
10.化学实验设计和操作中必须十分重视安全问题和环境保护问题。下列实验问题处理方法不正确的是[ ]
① 制氧气时排水法收集氧气后出现倒吸现象,立即松开试管上的橡皮塞
② 在气体发生装置上直接点燃一氧化碳气体时,必需要先检验一氧化碳气体的纯度。最简单的方法是用排空气的方法先收集一试管气体,点燃气体,听爆鸣声。
③ 实验结束后将所有的废液倒入下水道排出实验室,以免污染实验室
④ 给试管中的液体加热时不时移动试管或加入碎瓷片,以免暴沸伤人
⑤ 不慎将酸溅到眼中,应立即用水冲洗,边洗边眨眼睛
⑥ 配制浓硫酸时,可先在烧杯中加一定体积的水,再边搅拌边加入浓硫酸
A. ①② B. ②③ C. ③⑤ D. ②⑥
9. 某温度下,在密闭容器中发生如下反应: 2A(g)+
B(g) 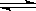 2C(g),若开始时只充入2mol C气体,达到平衡时,混合气体的压强比起始时增大了20%;若开始时只充入2mol A和1mol B的混合气体,达到平衡时A的转化率为[ ]
2C(g),若开始时只充入2mol C气体,达到平衡时,混合气体的压强比起始时增大了20%;若开始时只充入2mol A和1mol B的混合气体,达到平衡时A的转化率为[ ]
A.20% B. 40% C. 60% D. 80%
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com