
题目列表(包括答案和解析)
25.(5分)在一定温度下,向一个容积不变的容器中,加入3molSO2和2molO2 及固体催化剂,使之发生反应: 2SO2(g)
+ O2 (g)  2SO3 (g) △H=-196.6kJ/mol 平衡时容器内气体压强为起始时的90%。此时
2SO3 (g) △H=-196.6kJ/mol 平衡时容器内气体压强为起始时的90%。此时
Ⅰ、加入3molSO2和2molO2 发生反应,达到平衡时,放出的热量为 。
Ⅱ、保持同一反应温度,在相同的容器中,将起始物质的量改为amolSO2、bmolO2、cmolSO3(g),欲使平衡时SO3的体积分数为2/9 ,
①达到平衡时,Ⅰ与Ⅱ放出的热量 (填序号)。
A.一定相等 B.前者一定小 C.前者大于或等于后者 D.前者小于或等于后者
②a、b、c必须满足的关系是(一个用a、c表示,另一个用b、c表示)
,
③欲使起始时反应表现为向正反应方向进行,a的取值范围是: 。
24.某课外活动小组利用以下装置探究氯气与氨气之间的反应。其中A 、F 分别为氨气和氯气
的发生装置,C为纯净的氯气于氨气反应的装置。

请回答下列问题:
(1)装置F中发生反应的离子方程式 。
(2)装置A中烧瓶内固体可以选用 (选填以下选项的代号)。
A.碱石灰 B.生石灰 C.二氧化硅
D.五氧化二磷 E.烧碱 F.氢氧化钠和氯化铵的混合物
(3)上图A-F是按正确实验装置顺序排列的。虚线框内应添加必要的除杂装置,
请从上图的备选装置中选择,并将编号填人下列空格:B D E
(4)氯气和氨气在常温下混合就会反应生成氯化铵和氮气,写出反应的化学方程式
。
装置C内出现浓厚的白烟并在容器内壁凝结,请设计一个实验方案检验其中的NH4+
(5)若从装置C的G处逸出的尾气只含有N2和少量Cl2,应如何处理才能不污染环境?
23.(11分)已知①A、B、C、D、E为单质,其余为化合物;②常温下K为无色液体 ③D和Y既可以与X的水溶液反应,也能与Z的稀溶液反应;④常温下,可用C或D的容器贮运Z的浓溶液。它们之间的转化关系如下图所示(反应条件均已略去)。

请回答下列问题:
(1)D的原子结构示意图为 。
(2)化合物M含有的化学键式 。
(3)D与X的水溶液反应的离子方程式是 。
(4)金属铜与Z的溶液反应的化学方程式是 。
(5)工业上制取B的化学方程式是 。
(6)实验测得的G的相对分子质量比理论值的的原因是
。
22.(6分)(1)已知在0.1 mol·L-1的NaHSO3溶液中有关微粒浓度由大到小的顺序为:
c(Na+) > c(HSO3-) > c(SO32-) > c(H2SO3yc)。则:
① 则该溶液中c(H+) c(OH-)(填“>”“<”“=”),简述理由
② 现向NH4HSO3溶液中,逐滴加入少量含有酚酞的氢氧化钠溶液,可观察到的现象是
;写出该反应的离子方程式 。
(2)0.3 mol的气态高能燃料乙硼烷(B2H6)在氧气中燃烧,生成固态三氧化二硼和液态水,放出649.5kJ热量,其热化学方程式为
又已知H2O(l) = H2O(g);△H = +44kJ/mol,则0.5mol乙硼烷完全燃烧生成气态水时放出的热量是 kJ。
21. (7分)随着科学技术的发展,阿伏加德罗常数的测定手段越来越多,测定的精确度也越来越高。现有一种简单可行的测定的方法,具体步骤为:
(7分)随着科学技术的发展,阿伏加德罗常数的测定手段越来越多,测定的精确度也越来越高。现有一种简单可行的测定的方法,具体步骤为:
(1)将固体NaCl细粒干燥后,准确称取mg NaCl固体并转移到定容仪器A中;
(2)用滴定管向A仪器中加苯,不断振荡,继续加苯至A仪器的刻度,计算出NaCl固体的体积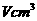 。请回答下列问题:
。请回答下列问题:
①步骤(1)中A仪器最好使用___________。(填序号)
A、量筒 B、烧杯 C、容量瓶 D、试管
②步骤(2)中用酸式滴定管还是用碱式滴定管_ ____,理由是_____ 。
③能否用水代替苯________,理由是_____________________________________。
④已知NaCl晶体中,靠得最近的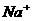 与
与 间的平均距离为a cm(如右图3-4),用上述测定方法测得的阿伏加德罗常数
间的平均距离为a cm(如右图3-4),用上述测定方法测得的阿伏加德罗常数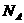 的表达式为________________________。
的表达式为________________________。
20.用pH大小表示溶液的酸性相对强弱有许多不足之处。因此,荷兰科学家HenK VanLubeek引入酸度(AG)的概念,即把电解质溶液中的酸度定义为c (H+)与c (OH-)比值的对数,用公式表示为AG = lg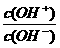 。常温下,AG = 10的溶液中能大量共存的离子组是( )
。常温下,AG = 10的溶液中能大量共存的离子组是( )
A.Na+、K+、Cl-、F- B.Na+、K+、ClO-、S2-
C.NH4+、Fe3+、Cl-、NO3- D.Na+、K+、CO32-、AlO2-
第Ⅱ卷(非选择题,共60分)
19.下列实验设计能够成功的是
|
|
实验目的 |
实验步骤及现象 |
|
A |
检验亚硫酸钠试样是否变质 |
 |
|
B |
检验某卤代烃是否是氯代烃 |
 |
|
C |
证明酸性条件H2O2氧化性比I2强 |
 |
|
D |
除去氯化钠晶体中少量硝酸钾 |
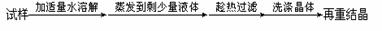 |
18. 高铁电池是一种新型可充电电池,与普通高能电池相比,该电池能长时间保持稳定的放电电压。高铁电池的总反应为
高铁电池是一种新型可充电电池,与普通高能电池相比,该电池能长时间保持稳定的放电电压。高铁电池的总反应为
下列叙述不正确的是
A.放电时负极反应为:Zn-2e- +2OH-= Zn(OH)2
B.充电时阳极反应为:Fe(OH)3
-3e- + 5 OH- = FeO + 4H2O
+ 4H2O
C.放电时每转移3 mol电子,正极有1mol K2FeO4被氧化
D.放电时正极附近溶液的碱性增强
17.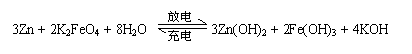 有A、B两种元素能互相结合生成两种化合物C1和C2,其中C1的化学式 为AB2,且C1中含A 50%,C2含A 40%,则C2的化学式是( )
有A、B两种元素能互相结合生成两种化合物C1和C2,其中C1的化学式 为AB2,且C1中含A 50%,C2含A 40%,则C2的化学式是( )
A.A2B B.AB C.A2B2 D.AB3
16.在元素周期表短周期中的X和Y两种元素可组成化合物XY3,下列说法正确的是( )
A.XY3晶体一定是离子晶体 B.XY3中的各原子最外层一定都满足8电子稳定结构
C.X和Y一定不属于同一主族 D.若Y的原子序数为m,X的原子序数可能是m±4
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com