
题目列表(包括答案和解析)
8. 关于酸碱中和滴定的下列叙述正确的是
A.盛待测液的锥形瓶未用待测液润洗
B.中和滴定开始后,应注视滴定管内液面的变化
C.滴定至终点后,记录读数为21.0 mL
D.用已知浓度的盐酸来滴定NaOH溶液时,酸式滴定管中开始读数正确,终了时俯视读数,所测NaOH溶液的浓度偏高
7. 氢镍电池是近年开发出来的可充电电池,它可以取代会产生污染的铜镍电池。氢镍电池的总反应式是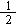 H2+NiO(OH)
H2+NiO(OH) Ni(OH)2。根据此反应式判断,下列叙述中正确的是
Ni(OH)2。根据此反应式判断,下列叙述中正确的是
A.电池放电时,电池负极周围溶液的OH-不断增大
B.电池充电时,氢元素被还原
C.电池放电时,镍元素被氧化
D.电池放电时,H2是正极
6. 将10 mL 0.2 mol·L-1的醋酸和10 mL 0.1 mol·L-1的NaOH溶液等体积混合,所得溶液的离子浓度关系正确的是
A.c(CH3COO-)>c(Na+)>c(H+)>c(OH-)
B.c(CH3COO-)>c(H+)>c(Na+)>c(OH-)
C.c(Na+)>c(CH3COO-)>c(OH-)>c(H+)
D.c(H+)>c(CH3COO-)>c(Na+)>c(OH-)
5. 将a L NH3通过灼热的装有铁触媒的硬质玻璃管后,气体体积变为b L(气体体积均在同温同压下测定)。该b L气体中NH3的体积分数是
A.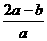 B.
B.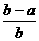 C.
C.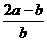 D.
D.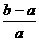
4.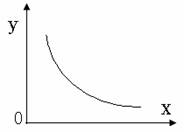 一定条件下,在某密闭容器中充入N2和H2,反应N2+3H2
一定条件下,在某密闭容器中充入N2和H2,反应N2+3H2 2NH3;ΔH<0达到平衡。改变一个条件x,下列y的变化一定符合图中曲线的是:
2NH3;ΔH<0达到平衡。改变一个条件x,下列y的变化一定符合图中曲线的是:
|
选项 |
x |
y |
|
A |
压强 |
H2的转化率 |
|
B |
压强 |
NH3的体积分数 |
|
C |
温度 |
NH3的体积分数 |
|
D |
温度 |
N2的体积百分含量 |
3. 具有相同电子层数的X、Y、Z三种元素,已知它们最高价氧化物的水化物的酸性强弱顺序是HXO4>H2YO4>H3ZO4,则下列判断正确的是
A.原子半径:X>Y>Z
B.元素的非金属性:X>Y>Z
C.气态氢化物的稳定性:X<Y<Z
D.阴离子的还原性:X>Y>Z
2. 冰的晶体中,分子间存在的最强的作用力是
A.离子键 B.共价键 C.氢键 D.范德瓦耳斯力
1. “勤俭节约,反对浪费”是中华民族的传统美德,以下“建设节约型社会”的措施符合科学原理和生产实际的是
A.在接触法制硫酸工业生产中,充分利用化学反应放出的热量,可节约能源
B.在汽油中掺加水,汽油燃烧产生的高温使水分解,生成的氢气和氧气燃烧时又放出大量的热,故“以水代油”可节约汽油
C.在CH3COONa 溶液中加水稀释,醋酸钠的水解平衡向水解的方向移动,OH-离子浓度增大,所以,“以水制碱”可节约原料
D.合成氨反应是一个气体分子数减少的反应,所以,目前工业上通常在100MPa(1000 atm)压强下反应,以提高氨的产率,节约原料,降低生产成本
28.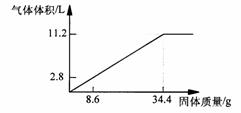 (6分)在100mLNaOH溶液中加入NH4NO3 和(NH4)2SO4
的固体混合物,加热使之充分反应,下图表示加入固体的的质量与产生气体的体积(标准状况)的关系。试计算:
(6分)在100mLNaOH溶液中加入NH4NO3 和(NH4)2SO4
的固体混合物,加热使之充分反应,下图表示加入固体的的质量与产生气体的体积(标准状况)的关系。试计算:
(1)NaOH溶液的物质的量浓度是_________ mol·L-1
(2)当NaOH溶液为140mL,固体为51.6g时,充分反应产生的气体为 ________ L(标准状况)
(3)当NaOH溶液为180mL,固体仍为51.6g时,充分反应产生的气体为_______L(标准状况)。
26.(7分)已知物质A显酸性,F为七原子组成的环状结构,请根据以下框图回答问题:
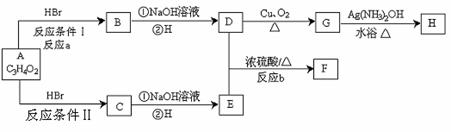
(1)A、H的结构简式为 、
(2)a、b的反应类型分别为 、
(3)D和E生成F的化学方程式
(4)写出c的同分异构体中属于酯类物质的结构简式
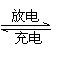 (任写2种)
(任写2种)
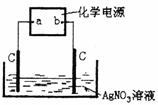 27.(8分)如图所示:化学电源的原理为:Fe + NiO2 + 2H2O
Fe(OH)2 + Ni(OH)2,利用该装置电解一段时间后,右边的石墨电极上增重2.16g。
27.(8分)如图所示:化学电源的原理为:Fe + NiO2 + 2H2O
Fe(OH)2 + Ni(OH)2,利用该装置电解一段时间后,右边的石墨电极上增重2.16g。
(1)写出电解池中电解时发生的离子方程式:
(2)电源a极上发生的电极方程式
(3)电解一段时间后,化学电源的电能被消耗,若要对其进行充电,电源负极应连接
(填 “a”或“b”)该电极的方程式为
(4)若电解液的体积为200mL(不考虑电解过程中的体积变化),则电解后溶液的pH为 。
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com