
题目列表(包括答案和解析)
6. 2005年诺贝尔化学奖获得者施罗克等人发现金属钼的卡宾化合物可以作为非常有效的烯烃复分解催化剂。工业上冶炼钼的化学原理为:①2MoS2 + 7O2  2MoO3 + 4SO2; ②MoO3 + 2NH3·H2O = (NH4)2MoO4
+ H2O; ③(NH4)2MoO4 +
2HCl = H2MoO4↓+ 2NH4Cl;④H2MoO4
= MoO3 + H2O;⑤ 用还原剂将MoO3还原成金属钼。则下列说法正确的是( )
2MoO3 + 4SO2; ②MoO3 + 2NH3·H2O = (NH4)2MoO4
+ H2O; ③(NH4)2MoO4 +
2HCl = H2MoO4↓+ 2NH4Cl;④H2MoO4
= MoO3 + H2O;⑤ 用还原剂将MoO3还原成金属钼。则下列说法正确的是( )
A.MoS2煅烧产生的尾气可直接排空
B.MoO3不溶于氢氧化钠溶液
C.H2MoO4是一种强酸
D.利用H2、CO和铝分别还原等量的MoO3,消耗还原剂的物质的量之比为3:3:2
5.
 有一未完成的离子方程式:
+XO3-+6H+=3X2+3H2O,据此判断:X元素的最高化合价为( )
有一未完成的离子方程式:
+XO3-+6H+=3X2+3H2O,据此判断:X元素的最高化合价为( )
A.+7 B.+5 C.+4 D.+1
4. U常见化合价有+4和+6,硝酸铀酰[UO2(NO3)2]加热可发生如下分解,UO2(NO3)2 -- UxOY + NO2↑+ O2↑,在600K时,将气体产物收集于试管中并倒扣于中气体全部被吸收,水充满试管。则生成的铀的氧化物化学式是( )
A.UO2 B.UO3 C.2UO2·UO3 D.UO2·2UO3
3. 据2006年5月的报道:齐齐哈尔第二制药厂,用丙二醇代替二甘醇,生产了一批假药,给 病人的生命带来了很大的危害。则丙二醇的化学式为( )
A.C3H6O2 B.C3H8O3 C.C3H8O2 D.C4H10O2
2. 2005年美国《Science》上发表论文,宣布发现了一种Al的超原子结构,这种超原子(Al13)是以1个Al原子在中心,12个Al原子在表面形成的三角二十面体结构。这种超原子具有40个价电子时最稳定。请预测稳定的Al13所带的电荷为( )
A.+3 B.+2 C.0 D.-1
1. 成语、谚语、歇后语、缩语等都是中华民族几千年传统文化的积淀,其中一些包含丰富的化学知识。下列各项中只发生物理变化的是( )
A.烈火炼真金 B. 只要功夫深,铁杵磨成针 C. 火树银花 D.雷雨肥庄稼
22.(10分)已知:25 ℃时,A酸的溶液pH=a,B碱的溶液pH=b。
(1)若A为盐酸,B为氢氧化钡,且a+b=14,两者等体积混合,溶液的pH= 。酸碱按体积比为1∶10混合后溶液显中性,则a+b= 。
(2)若A为醋酸,B为氢氧化钠,且a+b=14,用体积为VA的醋酸和体积为VB的氢氧化钠溶液混合后,溶液显中性,则其体积关系VA VB,混合后溶液中的离子浓度关系为c(Na+) c(CH3COO-)。
(3)若A的化学式为HR,B的化学式为MOH,且a+b=14,两者等体积混合后溶液显碱性。则混合溶液中必定有一种离子能发生水解,该水解反应的离子方程式为 。
21.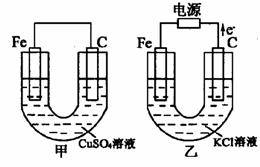 (8分)根据右图所提供的信息,在反应一段时间后:
(8分)根据右图所提供的信息,在反应一段时间后:
(1)甲池中的现象为:
。
(2)甲池中总反应的离子方程式为
。
(3)若乙池中反应转移1 mol e-后停止,则要使溶液恢复至原状,需加入 g
(填物质名称)。
(4)若乙池反应10 min后,立即将电源连接方向交换(与上述的图示相反),则铁棒上的电极反应式为 。
20.(12分)在一定温度下,将2 mol A和2 mol B两种气体混合于2
L的密闭容器中,发生如下反应:2A(g)+B(g)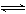 2C(g)+2D(g),2 min末反应达到平衡状态,生成了0.8 mol D。请填写下列空白:
2C(g)+2D(g),2 min末反应达到平衡状态,生成了0.8 mol D。请填写下列空白:
(1)从反应开始至达到平衡,用D表示的平均反应速率为 。
(2)B的平衡浓度为 ,A的转化率为 。
(3)在温度不变时,如果缩小容器的体积,平衡体系中混合气体的密度 、平均相对分子质量 (两空均填“增大”、“减小”或“不变”)。
(4)如果上述反应在相同条件下从逆反应开始进行,最初加C和D各2 mol,要使平衡各物质的体积分数与原平衡相等,则还应加入 mol B物质。
19.(10分)A、B、C、D均为短周期元素,A和B是同周期相邻的两种元素,A和C是同主族相邻的两种元素;A、B、C三种元素的原子序数之和为31,D元素与A、B、C三种元素处于不同周期。请回答:
(1)C元素的名称 ;A、D两种元素形成的离子电子式为 。
(2)A、B、C、D四种元素组成的正盐的水溶液显酸性,用离子方程式表示其原因为___________________________________________________。
(3)BD3与BA2的反应常用于某工业尾气的处理,该反应的化学方程式为
。
(4)D2C和D2A2溶液反应生成了C的单质,该反应的化学方程式为
。
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com