
题目列表(包括答案和解析)
6、( )甲、乙两容器都发生反应 2A(g)+ B(g )  xC(g),两容器温度和初始压强都相同。甲容器中充入 2 molA 和 1 molB,达平衡后,C 在平衡混合气中的体积分数为φ、物质的量为 n1;乙容器中充入 1.4
molA,0.7 molB 和 0.6 molC,达平衡后 C 在平衡混合气中的体积分数为φ、物质的量为 n2。下列说法中正确的是
xC(g),两容器温度和初始压强都相同。甲容器中充入 2 molA 和 1 molB,达平衡后,C 在平衡混合气中的体积分数为φ、物质的量为 n1;乙容器中充入 1.4
molA,0.7 molB 和 0.6 molC,达平衡后 C 在平衡混合气中的体积分数为φ、物质的量为 n2。下列说法中正确的是
A.若甲、乙两容器均为恒容容器,则 x必等于 2
B.若甲、乙两容器均为恒压容器,则 x必等于 3
C.若甲为恒压容器、乙为恒容容器,且 x≠3,则 n1必大于 n2
D.若甲为恒容容器、乙为恒压容器,且 x= 3,则 n1必大于 n2
5、( )在恒温恒压下,将3molA和1molB放入一密闭容器中发生反应:2A(g)+B(g) 2C(g),
2C(g),
达到化学平衡(Ⅰ)。在同样条件下,3molA和2molB发生同样的反应,达到化学平衡(Ⅱ)。现
将平衡(Ⅱ)的混合气全部压入平衡(Ⅰ)的容器中,在同样条件下达到化学平衡(Ⅲ)。下面关于平
衡(Ⅰ)、(Ⅱ)、(Ⅲ)的说法错误的是:
A.平衡(Ⅲ)中A的转化率等于B的转化率 B.平衡(Ⅰ)中A的转化率小于B的转化率
C.n(C)/n(A)的比值,平衡(Ⅲ)比平衡(Ⅰ)小 D.n(A)/n(B)的比值,平衡(Ⅲ)比平衡(Ⅱ)小
3、( )已建立化学平衡的某可逆反应,当条件改变使化学平衡向正反应方向移动时,下列叙述正确的是
①生成物的质量分数一定增加 ②生成物产量一定增加
③反应物的转化率一定增大 ④反应物的浓度一定降低
⑤正反应速度一定大于逆反应速度 ⑥一定使用催化剂
A.①②⑤ B.③④⑤ C.②⑤ D.④⑥
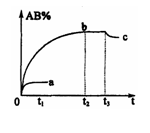 ( )4、反应
( )4、反应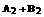
 2AB;△H=Q,在不同温度和压强改变
2AB;△H=Q,在不同温度和压强改变
的条件下,产物AB的质量分数AB%生成情况如下图:a为500℃
时的情况;b为300℃时的情况;c为反应在300℃时从时间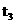 开
开
始向容器中加压的情况.则下列叙述正确的是
A.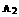 、
、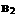 及AB均为气体,Q>0
及AB均为气体,Q>0
B.AB为气体,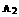 、
、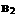 中至少有一种为非气体,Q<0
中至少有一种为非气体,Q<0
C.AB为气体,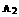 、
、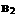 中有一种为非气体,Q<0
中有一种为非气体,Q<0
D.AB为固体,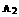 、
、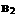 中有一种为非气体,Q>0
中有一种为非气体,Q>0
1、在恒温恒容条件下,将4molA和2molB放入一密闭容器中发生反应:2A(g)+B(g) 2C(g)+D(s),达到平衡时,C的体积分数为a;在相同条件下,按下列配比分别投放A、B、C、D,达到平衡时,C的体积分数不等于a的是:
2C(g)+D(s),达到平衡时,C的体积分数为a;在相同条件下,按下列配比分别投放A、B、C、D,达到平衡时,C的体积分数不等于a的是:
A.4mol、2mol、0mol、2mol B.2mol、1mol、2mol、2mol
C.2mol、1mol、2mol、1mol D.2mol、1mol、0mol、1mol
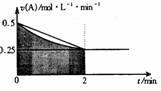 ( )2、某溶液中发生反应:A=2B+C,A的反应速率v(A)与时间t的图象如图所示。若溶液的体积为2L,且起始时只加入A物质,下列说法错误的是:
( )2、某溶液中发生反应:A=2B+C,A的反应速率v(A)与时间t的图象如图所示。若溶液的体积为2L,且起始时只加入A物质,下列说法错误的是:
A.图中阴影部分的面积表示0-2min内A的物质的量浓度的减小值
B.反应开始的前2min,A的平均反应速率小于0.375mol·L-1·min-1
C.至2min时,A的物质的量减小值介于0.5mol至1mol之间
D.至2min时,c(B)介于1mol·L-1 至1.5mol·L-1 之间
22.(8分)为了测定溶液中Ba2+的浓度,做了以下实验:
① 称取0.1224gK2Cr2O7溶于适量的稀硫酸中,再向其中加入过量的KI溶液与之反应,反应后的溶液加入24.00mLNa2S2O3溶液时恰好反应完全。
② 另取50.00mLBa2+溶液,控制适当的酸度,加入足量K2CrO4的溶液,得BaCrO4沉淀,沉淀经过滤、洗涤后,用适量稀盐酸溶解,使CrO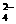 转化Cr2O
转化Cr2O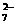 ,再加入过量KI与之反应,反应后再同上述 Na2S2O3溶液反应,反应完全时,消耗Na2S2O3溶液25.00mL,与之有关反应式如下:
,再加入过量KI与之反应,反应后再同上述 Na2S2O3溶液反应,反应完全时,消耗Na2S2O3溶液25.00mL,与之有关反应式如下:
□Cr2O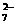 +□I-+□H+--□Cr3++□I2+□H2O □I2+□S2O
+□I-+□H+--□Cr3++□I2+□H2O □I2+□S2O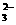 --□S4O
--□S4O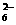 +□I-
+□I-
(1)配平上述的离子方程式。
(2)上述两步可用_________________作指示剂,其现象为
(3)试计算溶液中Ba2+的物质的量浓度
21.(11分) 某一反应体系中共有Pb3O4、NO、MnO2、Cr2O3、Cr(MnO4)2和Pb(N3)2(名称叠氧化铅,其中Pb为+2价,N平均为-1/3价)六种物质,已知Pb(N3)2是反应物之一。根据你学过的有关化学定律和知识,回答下列问题:
(1)铅(Pb)的常见化合价是 ,将Pb3O4写成常见化合价的氧化物的形式为 __ (已知Fe3O4可写成FeO·Fe2O3)。
(2)已知Cr的常见化合价为+2、+3、+6,Mn的常见化合价为+2、+4、+6、+7,则Cr(MnO4)2中Cr的化合价为 ,Mn的化合价为 。
(3)Pb(N3)2在该反应中是 剂,它的氧化产物是 ,1mol Pb(N3)2参加反应,转移电子数是 mol。
(4)试写出并配平这个反应的化学方程式。Pb(N3)2+
 。
。
20.(6分)1774年,英国科学家Franklin在皇家学会上宣读论文时提到:“把4.9cm3油脂放到水面上,立即使水面平静下来,并令人吃惊的蔓延开去,使2.0×103m2水面看起来象玻璃那样光滑”。
(1)已知油脂在水面上为单分子层,假设油脂的摩尔质量为M,每个油脂分子的横截面积为Acm2,取该油脂mg,配成体积为VmmL的苯溶液,将该溶液滴加到表面积为Scm2的水中,若每滴溶液的体积为VdmL,当滴入第d滴油脂苯溶液时,油脂的苯溶液恰好在水面上不再扩散,则阿伏加得罗常数NA的表达式为NA= ;
(2)水面上铺一层油(常用十六醇、十八醇,只有单分子厚),在缺水地区的实际意义是
19. (6分) 1918年,Lewis提出反应速率的碰撞理论:反应物分子间的相互碰撞是反应进行的必要条件,但并不是每次碰撞都能引起反应,只有少数碰撞才能发生化学反应。能引发化学反应的碰撞称之为有效碰撞。
(6分) 1918年,Lewis提出反应速率的碰撞理论:反应物分子间的相互碰撞是反应进行的必要条件,但并不是每次碰撞都能引起反应,只有少数碰撞才能发生化学反应。能引发化学反应的碰撞称之为有效碰撞。
(1)20世纪30年代,Eyring和Pelzer在碰撞理论的基础 上提出化学反应的过渡态理论:化学反应并不是通过简单的碰撞就能完成的,而是在反应物到生成物的过程中经过一个高能量的过渡态。图Ⅱ是NO2和CO反应生成CO2和NO过程中能量变化示意图,请写出NO2和CO反应的热化学方程式: ;
(2)进一步研究表明,化学反应的能量变化(ΔH)与反应物和生成物的键能有关。键能可以简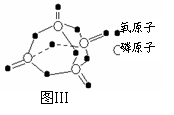 单的理解为断开1 mol 化学键时所需吸收的能量。下表是部分化学键的键能数据:
单的理解为断开1 mol 化学键时所需吸收的能量。下表是部分化学键的键能数据:
|
化学键 |
P-P |
P-O |
O=O |
P=O |
|
键能/ kJ·mol–1 |
197 |
360 |
499 |
X |
已知白磷的燃烧热为2378.0 kJ/mol,白磷完全燃烧的产物结如图Ⅲ所示,则上表中X= 。
18.(8分) pH<7的溶液中含有三种常见金属阳离子,用x溶液进行如下实验:
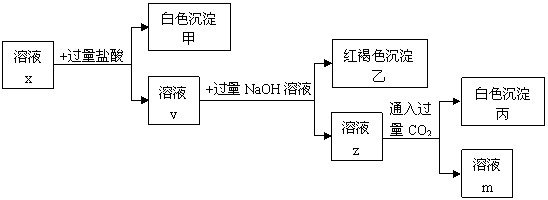
(1)根据有白色沉淀甲生成,判断x溶液中有 阳离子。
(2)根据有白色沉淀丙生成,判断x溶液中有 阳离子;由溶液z生成沉淀丙的离子方程式为 。
(3)x溶液中一定含有的阴离子是 。
(4)根据上述实验 (填“能”或“不能”)确定x溶液中的第3种金属阳离子,理由是 。
17.(13分) 某校化学实验兴趣小组在“探究卤素单质的氧化性”的系列实验中发现:在足量的稀氯化亚铁溶液中,加入1-2滴溴水,振荡后溶液呈黄色。
(1)提出问题:Fe3+、Br2谁的氧化性更强?
(2)猜想
① 甲同学认为氧化性:Fe3+>Br2,故上述实验现象不是发生化学反应所致,则溶液呈黄色是含____________(填化学式,下同)所致。
② 乙同学认为氧化性:Br2>Fe3+,故上述实验现象是发生化学反应所致,则溶液呈黄色是含_____________所致。
(3)设计实验并验证
丙同学为验证乙同学的观点,选用下列某些试剂设计出两种方案进行实验,并通过观察实验现象,证明了乙同学的观点确实是正确的。
供选用的试剂:a.酚酞试液;b.CCl4; c.无水酒精;d. KSCN溶液。
请你在下表中写出丙同学选用的试剂及实验中观察到的现象。(试剂填序号)
|
|
选用试剂 |
实验现象 |
|
方案1 |
|
|
|
方案2 |
|
|
(4)结论
氧化性:Br2>Fe3+。故在足量的稀氯化亚铁溶液中,加入1-2滴溴水,溶液呈黄色所发生的离子反应方程式为______________________________。
(5)实验后的思考
① 根据上述实验推测,若在溴化亚铁溶液中通入氯气,首先被氧化的离子是_______(填离子的化学式)。
② 在100mL FeBr2溶液中通入2.24L Cl2(标准状况),溶液中有1/2的Br-被氧化成单质Br2,则原FeBr2溶液中FeBr2的物质的量的浓度为_______________。
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com