
题目列表(包括答案和解析)
17.(12分)(1)有常用玻璃仪器组成的下列六种实验装置(根据需要可在其中加入液体或固体)
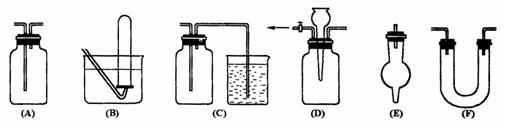
①能用做干燥二氧化硫气体的装置有 ;(填代号,下同)
②既能用于收集氯气又能用于收集一氧化氮气体的装置有 ;
③在氯气和铁反应实验中,能添加在制气和化合反应装置之间以除去氯气中氯化氢等杂质气体的装置有 ;
(2)学校化学兴趣小组知道二氧化锰能作过氧化氢分解的催化剂后,想再探究其他一些物质如氧化铝是否也可以作过氧化氢分解的催化剂。请你一起参与他们的探究过程。
①[问题]:Al2O3能不能作过氧化氢分解的催化剂呢?
②[猜想]:Al2O3能作过氧化氢分解的催化剂。
③[实验验证]:
|
|
实验步骤 |
实验现象 |
实验结论 |
|
实验一 |
|
木条不复燃 |
常温下过氧化氢溶液不分解 |
|
实验二 |
在装有过氧化氢溶液的试管中加入少量Al2O3,然后将带火星的木条伸入试管中 |
木条复燃 |
|
④[结论]:Al2O3能加快过氧化氢分解速率,故Al2O3能作过氧化氢分解的催化剂。
⑤[讨论与反思]:经过讨论,有的同学认为只有上述两个证据,不能证明Al2O3能作过氧化氢的催化剂,还要补充一个探究实验:
实验三:[实验目的]:探究 。
[实验步骤]:①准确称量Al2O3(少量)的质量;②完成实验二;③待反应结束后,将实验二试管里的物质进行过滤、洗涤、干燥、称量;④对比反应前后Al2O3的质量。
[讨论]:如果Al2O3在反应前后质量不变,则说明Al2O3可以作过氧化氢分解的催化剂。
⑥但小华认为,要证明猜想,上述三个实验还不足够,还需要再增加一个探究实验:探究
。
15.2005年诺贝尔化学奖获得者施罗克等人发现金属钼的卡宾化合物可以作为非常有效的烯烃复分解催化剂。工业上冶炼钼的化学原理为
①2MoS2+7O2 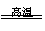
 2MoO3+4SO2;
2MoO3+4SO2;
②MoO3+2NH3·H2O====(NH4)2MoO4+H2O;
③(NH4)2MoO4+2HCl====H2MoO4↓+2NH4Cl;
④H2MoO4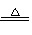
 MoO3+H2O; ⑤用还原剂将MoO3还原成金属钼。
MoO3+H2O; ⑤用还原剂将MoO3还原成金属钼。
则下列说法正确的是
A.MoS2煅烧产生的尾气可直接排空 B.MoO3是金属氧化物,也是碱性氧化物
C.H2MoO4是一种强酸
D.利用H2、CO和铝分别还原等量的MoO3,所消耗还原剂的物质的量之比为3∶3∶2
16.铁粉和铜粉的均匀混合物,平均分成四等份,分别加入同浓度的稀硝酸,充分反应,在标准状况下生成NO的体积和剩余金属的质量如下表(设硝酸的还原产物只有NO):
|
编号 |
① |
② |
③ |
④ |
|
稀硝酸体积/mL |
100 |
200 |
300 |
400 |
|
剩余金属/g |
18.0 |
9.6 |
0 |
0 |
|
NO体积/mL |
2240 |
4480 |
6720 |
V |
下列计算结果正确的是( )
A.①中溶解了5.6gFe B.硝酸的浓度为4mol/L
C.②中溶解了9.6gCu D.④中V=8960
第Ⅱ卷(非选择题,共86分)
14.时钟反应或振荡反应提供了迷人课堂演示实验,也是一个活跃的研究领域。测定含I-浓度很小的碘化物溶液时,利用振荡反应进行化学放大,以求出原溶液中碘离子的浓度。主要步骤如下:
①在中性溶液中,用溴将试样中I-氧化成IO3-,将过量的溴除去。
②再加入过量的KI,在酸性条件下,使IO3-完全转化成I2。
③将②中生成的碘完全萃取后,用肼将其还原成I-,方程式为:N2H4+2I2==4I-+N2+4H+
④将生成的I-萃取到水层后用①法处理。
⑤将④得到的溶液加入适量的KI溶液,并用硫酸酸化。
⑥将⑤反应后的溶液以淀粉作指示剂,用Na2S2O3标准液滴定,方程式为:2Na2S2O3+I2==Na2S4O6+2NaI
经过上述放大后,则溶液中I-浓度放大为原溶液中I-浓度的(设放大前后溶液体积
相等): ( )
A.2倍 B.4倍 C.6倍 D.36倍
13.某可充电的锂离子电池以LiMn2O4为正极,嵌入锂的碳材料为负极,含Li+导电固体为电解质。放电时的电池反应为:Li + LiMn2O4 == Li2Mn2O4 。下列说法正确的是
A.放电时,LiMn2O4发生氧化反应
B.放电时,正极反应为:Li+ + LiMn2O4 + e- == Li2Mn2O4
C.充电时,LiMn2O4发生氧化反应
D.充电时,阳极反应为:Li+ + e- == Li
12.下列各溶液中,微粒的物质的量浓度关系正确的是
A.10mL 0.5mol/L CH3COONa溶液与6mL 1mol/L盐酸混合:
c(Cl-)>c(Na+)>c(H+)>c(OH-)
B.0.1mol/L pH为4的NaHB溶液中:
c(HB-)>c(H2B)>c(B2-)
C.在NaHA溶液中一定有:
c(Na+)+c(H+)=c(HA-)+c(OH-)+c(A2-)
D.c(NH4+)相等的(NH4)2SO4溶液、(NH4)2CO3溶液和NH4Cl溶液:
c[(NH4)2SO4]<c[(NH4)2CO3]<c(NH4Cl)
11.右图是NaCl晶体的一个晶胞结构模型。KO2的晶体结构与NaCl相似,KO2可以看作是Na+的位置用K+代替,Cl-位置用O2-代替,则关于KO2晶体结构的描述正确的是
A.与K+距离相等且最近的O2-共有8个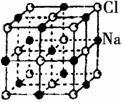
B.与K+距离相等且最近的O2-构成的多面体是8面体
C.与K+距离相等且最近的K+有8个
D.一个KO2晶胞中摊得的K+和O2-粒子数均为4个
10.某溶液中大量存在以下五种离子:NO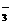 、SO42
、SO42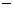 、Fe3+、H+、M,其物质的量之比为:n(NO
、Fe3+、H+、M,其物质的量之比为:n(NO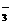 ):n(SO2
):n(SO2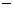 4):n(Fe3+):n(H
4):n(Fe3+):n(H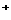 ):n(M)=2︰3︰1︰3︰1,则M可能是
):n(M)=2︰3︰1︰3︰1,则M可能是
A.Fe2+ B.Mg2+ C.Cl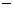 D.Ba2+
D.Ba2+
9.下列离子方程式书写正确的是
A.氢氧化铁与足量的氢溴酸溶液反应:Fe(OH)3+3H+=Fe3++3H2O
B.氯化钙溶液中通入二氧化碳气体:Ca2++CO2+H2O=CaCO3↓+2H+
C.等物质的量的Ba(OH)2与NH4HSO4在稀溶液中反应:
Ba2++2OH-+2H++SO42-=BaSO4↓+2H2O
D.碳酸氢镁溶液中加入过量石灰水:
Mg2++2HCO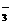 +Ca2++2OH-====CaCO3↓+2H2O+MgCO3↓
+Ca2++2OH-====CaCO3↓+2H2O+MgCO3↓
8.用NA表示阿伏加德罗常数,下列说法正确的是:
①18g D2O含有的电子数为10NA ②同温、同压下,相同体积的氟气和氩气所含的原子数相等 ③标准状况下,11.2L以任意比例混合的氮气和氧气所含的原子数为NA ④在标准状况下,22.4LSO3的物质的量为1mol ⑤4℃时5.4mL的水所含的原子总数为0.9NA ⑥0.1molOH-含0.1NA个电子 ⑦1mol Na2O2与水完全反应时转移电子数为2NA
A.③⑤⑥⑦ B.③⑤ C.①②④⑦ D.③④⑤⑥
7.化学中常用类比的方法可预测许多物质的性质。如根据H2+Cl2=2HCl推测:H2+Br2=2HBr。但类比是相对的,如根据2Na2O2+2CO2= Na2CO3+ O2, 类推2Na2O2+2SO2= Na2SO3+ O2是错误的,应该是Na2O2+SO2= Na2SO4。 下列各组类比中正确的是( )
A.由NH4Cl NH3↑+HCl↑,推测:NH4I
NH3↑+HCl↑,推测:NH4I NH3↑+HI↑
NH3↑+HI↑
B.由CO2+Ca(ClO)2+H2O=CaCO3↓+2HClO,推测:2SO2+Ca(ClO)2+H2O=CaSO3↓+2HClO
C.由2CO2+Ca(ClO)2+2H2O=Ca(HCO3)2+2HClO,推测:CO2+NaClO+H2O=NaHCO3+HClO
D.由Na2SO3+2HCl=2NaCl+H2O+ SO2↑,推测:Na2SO3+2HNO3=2NaNO3+H2O+ SO2↑
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com