
题目列表(包括答案和解析)
28.(10分)已知 (注:R,R’为烃基)
(注:R,R’为烃基)
A为有机合成中间体,在一定条件下发生消去反应,可能得到两种互为同分异构体的产物,其中的一种B可用于制取合成树脂、染料等多种化工产品。A能发生如下图所示的变化。
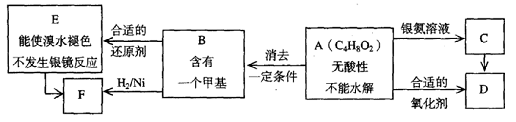
试回答
(1)写出符合下述条件A的同分异构体结构简式(各任写一种):
a.具有酸性______________________b.能发生水解反应______________________
(2)A分子中的官能团是_____________(填名称),D的结构简式是_____________。
(3)C→D的反应类型是___________,E→F的反应类型是___________
(4)写出化学方程式:A→B____________________________________________。
(5)C的同分异构体Cl与C有相同官能团,两分子Cl脱去两分子水形成含有六元环的C2,写出C2的结构简式:______________________________
27.(10分)有机物A和C遇FeCl3溶液均呈紫色,可发生转化:
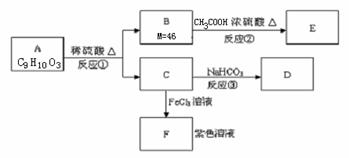
(1)A是一种苯的对位二取代产物,其结构简式:________ ;
(2)反应②为 反应(填反应类型)。
(3)反应③的化学方程式;_______ ;
(4)A与NaOH溶液共热生成C的钠盐。当1molA完全反应,溶液中消耗NaOH的物质的量:___________mol 。
(5)写出A的三种对位二取代产物的结构简式:____ 、___ 、________ 。
26.(10分)将2molSO2和1molO2混合置于体积可变,压强恒定的密闭容器中,在一定温度下发生如下反应:2SO2(g)+O2(g)  2SO3(g);△H﹤0,当反应进行到时间t1点时达到平衡状态,测得混合气体总物质的量为2.1 mol。试回答下列问题:
2SO3(g);△H﹤0,当反应进行到时间t1点时达到平衡状态,测得混合气体总物质的量为2.1 mol。试回答下列问题:
⑴该反应的平衡常数表达式: 。
 ⑵反应进行到t1时,SO2的体积分数为 。
⑵反应进行到t1时,SO2的体积分数为 。
⑶若在t1时充入一定量的氩气(Ar),SO2的物质的量将 __________
(填“增大”、“减小”或“不变”)。
⑷若在t1时升温,重新达到平衡状态,新平衡混合物中气体的总物质的量 2.1mol(填“<”、“>”或“=”),并简单说明原因 ________________________________________________________________________
⑸若其它条件不变,在t1时再加入0.2molSO3、0.1molO2 和1.8molSO3,在图中作A从0→t1→t2点这段时间内SO2的物质的量变化曲线。
25.(10分)氯碱工业中用离子交换膜法电解制碱的主要生产流程示意图如下:
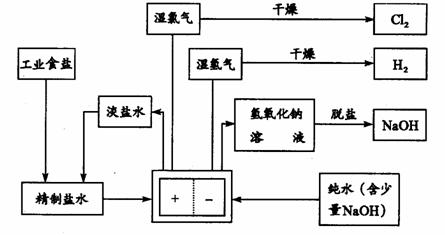
依据上图完成下列填空:
(1)与电源正极相连的电极上所发生反应的化学方程式为___________________;与电源负极相连的电极附近,溶液的pH__________(选填“不变”“升高”“降低”)。
(2)如果粗盐中SO42-含量较高,必须添加钡试剂除去SO42-,该钡试剂可以是 _____(选填a、b、c)。a.Ba(OH)2 b.Ba(NO3)2 c.BaCl2
(3)为有效除去Ca2+、Mg2+、SO42-,加入试剂的合理顺序为___________(选填a、b、c)。
a.先加NaOH,后加Na2CO3,再加钡试剂
b.先加NaOH;后加钡试剂,再加Na2CO3
c.先加钡试剂,后加NaOH,再加Na2CO3
(4)由图示可知用离子交换膜法电解制碱工艺中___________产品可循环使用。
(5)已知NaCl在60℃的溶解度为37.1 g,现电解60℃精制饱和食盐水1 371 g 经分析,电解后溶液密度为1.37 g·cm-3,其中含有20gNaCl,则电解后NaOH的物质的量浓度为__________mo1·L-1。
24.(10分)科学家从化肥厂生产的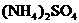 中检出组成为
中检出组成为 的物质,经测定,该物质易溶于水,在水中以
的物质,经测定,该物质易溶于水,在水中以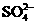 和
和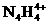 两种离子形式存在,植物的根系极易吸收
两种离子形式存在,植物的根系极易吸收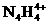 ,但它遇到碱时,会生成一种形似白磷的N4分子,N4分子不能被植物吸收。
,但它遇到碱时,会生成一种形似白磷的N4分子,N4分子不能被植物吸收。
请回答下列问题:
(1)N4和N2的关系正确的是 (填序号)
A. 同种单质 B. 同位素 C. 同分异构体 D. 同素异形体
(2)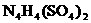 (填“能”或“不能”)和草木灰混合施用:
(填“能”或“不能”)和草木灰混合施用:
(3)已知白磷、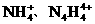 的空间构型均为四面体,
的空间构型均为四面体, 的结构式为
的结构式为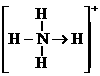 (
(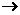 表示共用电子对由N原子单方面提供),白磷(P4)的结构式为
表示共用电子对由N原子单方面提供),白磷(P4)的结构式为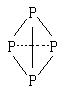 ,请画出
,请画出 的结构式
;
的结构式
;
(4)已知液氨中存在着平衡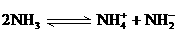 。科学家在液氨中加入氢氧化铯(CsOH)和特殊的吸水剂,使液氨中的
。科学家在液氨中加入氢氧化铯(CsOH)和特殊的吸水剂,使液氨中的 生成N4分子,请写出液氨与氢氧化铯反应的化学方程式:
;
生成N4分子,请写出液氨与氢氧化铯反应的化学方程式:
;
(5)含有一定量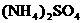 和NH3·H2O的水溶液称为“缓冲溶液”,在此溶液中加入少量的强碱或强酸时,溶液的pH几乎不变,这可由下列离子方程式来说明。
和NH3·H2O的水溶液称为“缓冲溶液”,在此溶液中加入少量的强碱或强酸时,溶液的pH几乎不变,这可由下列离子方程式来说明。
加酸时: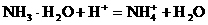
加碱时:
由于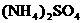 和
和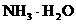 的大量存在,加少量酸或碱时,溶液中C(H+)与C(OH-)基本保持不变;
的大量存在,加少量酸或碱时,溶液中C(H+)与C(OH-)基本保持不变;
含有一定量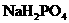 和
和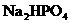 的溶液,也具有缓冲作用,写出此溶液中加入少量强酸或强碱时发生的离子反应方程式:
的溶液,也具有缓冲作用,写出此溶液中加入少量强酸或强碱时发生的离子反应方程式:
加酸时 ;
加碱时 。
23.(10分)在足量的稀氯化亚铁溶液中加入1-2滴液溴,振荡后溶液变为黄色。
(1) 甲同学认为是Br2溶于水变成黄色溶液 ; 乙认为是Fe2+被氧化成Fe3+使溶液变成黄色。
(2)现提供试剂:
A.酸性高锰酸钾溶液 B.氢氧化钠溶液 C.四氯化碳 D.硫氰化钾溶液
请判断 (填“甲”或“乙”)的推断正确,并用两种方法加以验证,写出选用的试剂编号及实验中观察到的现象:
|
|
选用试剂 |
实验现象 |
|
第一种方法 |
|
|
|
第二种方法 |
|
|
(3)①若选用淀粉碘化钾溶液判断哪位同学的推断正确,是否可行?(填“可行”或“不可行”):
________ ,理由: _____________________________ ;
②向稀溴化亚铁溶液中通入过量氯气的离子反应方程式: ______________ 。
22.(10分) ⑴ 以前实验室制备纯碱(Na2CO3)的主要步骤为:将饱和NaCl溶液倒入烧杯加热,控制30-35℃,搅拌下分批加入研细的NH4HCO3固体,加料完毕,保温30分钟,静置、过滤得NaHCO3晶体。用少量蒸馏水洗涤除去杂质、抽干,转入蒸发皿中灼烧得Na2CO3固体。
四种盐在不同温度下的溶解度表 (g/100g水)
|
温度 溶解度 |
0℃ |
10℃ |
20℃ |
30℃ |
40℃ |
50℃ |
60℃ |
100℃ |
|
NaCl |
35.7 |
35.8 |
36.0 |
36.3 |
36.6 |
37.0 |
37.3 |
39.8 |
|
NH4HCO3 |
11.9 |
15.8 |
21.0 |
27.0 |
- |
- |
- |
- |
|
NaHCO3 |
6.9 |
8.1 |
9.6 |
11.1 |
12.7 |
14.5 |
16.4 |
- |
|
NH4Cl |
29.4 |
33.3 |
37.2 |
41.4 |
45.8 |
50.4 |
55.3 |
77.3 |
①.反应控制在30-35℃,是因为高于35℃NH4HCO3会分解,低于30℃则反应速率降低 ,为控制此温度范围,通常采取的加热方法为_________________ ;
②.加料完毕,保温30分钟,目的_____________________________ ;
③.静置后只析出NaHCO3晶体的原因_______________________________ ;
④过滤所得母液中含有NaHCO3、NaCl 、NH4Cl、NH4HCO3,加入适当试剂并作进一步处理,使 _________(填化学式)循环使用,回收得到NH4Cl晶体。
⑵我国科学家侯德榜改革国外的纯碱生产工艺,使其更加先进,被称为侯德榜制碱法,生产流程为:
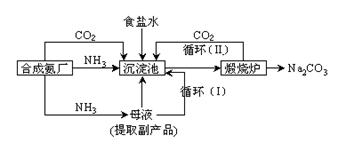
⑤ 沉淀池中反应的化学方程式: _______-_______ __ ;
⑥ 检验产品碳酸钠中是否含有氯化钠的操作方法为: 。
⑦循环(I)中应该加入或通入物质的化学式为 。
21.(10分)如图,盛有足量水的水槽里放两个烧杯,小烧杯里放有少量铜片和过量浓硝酸,小烧杯外面倒扣一个大烧杯,请回答:
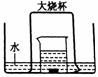 (1)铜与浓硝酸反应的化学方程式:_______________________;
(1)铜与浓硝酸反应的化学方程式:_______________________;
(2)实验中观察到的主要现象是:
①_______________________________ ;
②_______________________________ ;
③_______________________________ ;
④_______________________________ 。
(3)用该装置做铜与浓硝酸反应实验的优点:______________ ;
(4)大烧杯内最终所得气体产物的化学式: ;若要验证此气体产物,最简便的方法:_________________________________________ 。
20. 青石棉(cricidolite)是一种致癌物质,是《鹿特丹公约》中受限制的46种化学品之一,其化学式为Na2Fe5Si8O22(OH)2。青石棉用稀硝酸溶液处理时,还原产物只有NO,下列说法不正确的是( )
A.青石棉是一种复杂的硅酸盐
B.青石棉中含有一定量的石英晶体
C.青石棉的化学组成可表示为:Na2O·3FeO·Fe2O3·8SiO2·H2O
D.1mol青石棉能使1molHNO3被还原
19.塑料的焚烧会造成污染和二噁英问题,产生的酸性及腐蚀性气体(SO2、NO2、CO2等)危害较大,迫使塑料工业转向使用无毒、无公害、抑烟的无机阻燃剂[Mg(OH)2和Al(OH)3],而占市场份额较大的溴系阻燃剂逐渐受到限制;有关阻燃剂的说法正确的是( )
A. Mg(OH)2和Al(OH)3热分解生成的气态水可覆盖火焰,驱逐O2,稀释可燃气体
B.分解产物MgO和A12O3较快地中和塑料燃烧过程中产生的酸性及腐蚀性气体
C.溴系阻燃剂是目前世界上产量最大的有机阻燃剂,主要品种之一"八溴醚"
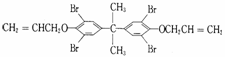
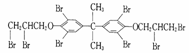
可由
发生取代反应得到
D. 制备"八溴醚”的起始物
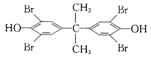 属于醇类
属于醇类
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com