
题目列表(包括答案和解析)
18.(12分)工业上测量SO2、N2、O2混合气体中SO2含量的装置如图;反应管装有碘的淀粉溶液。SO2和I2发生反应方程式为(N2、O2不与I2反应):
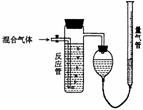
(1)混合气体进入反应管后,量气管内增加的水的体积等于 的体积(填写气体的分子式)。
(2)反应管内溶液蓝色消失卮,没有及时停止通气,则测得的SO2含量 (选填:偏高,偏低,不受影响)。
(3)反应管内的碘的淀粉溶液也可以用 代替(填写物质名称)。
(4若碘溶液体积为VamL.,浓度为Cmol·L-1,N2与O2的体积为VbmL(已折算为标准状况下的体积)。用C、Va、Vb表示SO2的体积百分含量为: 。
(5)将上述装置改为简易实验装置,除导管外,还需选用的仪器为. (选下列仪器的编号)。
a.烧杯 b.试管 c.广口瓶 d.容量瓶 e.量筒 f.单孔塞 g.双孔塞
17.(8分)(1)实验室常见到如图所示的仪器,该仪器为两头密封的玻璃管,中间带有一根玻璃短柄.当玻璃管内装有碘片时,用此仪器进行碘的升华实验,具有装置简单、操作方便、现象明显、可反复使用等优点.
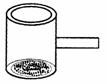
①用此仪器不能反复进行的实验是
A.NH4Cl受热分解的实验
B.KMnO4受热分解的实验
C.白磷和红磷在一定温度下相互转变的实验
D.无水CuSO4与胆矾的互变实验
②试再举一个能用此仪器进行反复实验的例子
|
|
|
|
|

 ①
①
|
|


|
|
|
|
|

|

|
|
|
|
|
 ④
④
|
|
|

|

|
结论:CuSO4是锌与稀硫酸反应的催化剂
16.类推是在化学学习和研究中常用的思维方法,但类推出的结论最终要经过实践的检验才能决定其正确与否,下列几种类推结论中不正确的是
A.钠、镁都是活泼金属,由金属钠和镁引起火灾都不能用干冰灭火器灭火
B.NaHC03溶液能与NaAl02反应生成白色沉淀,NaHS03溶液也能与NaAl02反应生成白色沉淀
C.NH4C1、NH4I结构相似,将两种固体分别加热,都分解生成HX和NH3
D.原电池中通常是活泼金属做负极,不活泼金属做正极,用铜和铝与浓硝酸构成原电池时,铝是负极
第Ⅱ卷(非选择题,共86分)
15.一定温度下,在恒容密闭容器中发生如下反应:2A(g) + B(g)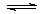 3C(g),若反应开始时充入2molA和2molB,达平衡后A的体积分数为a%。其它条件不变时,若按下列四种配比作为起始物质,平衡后A的体积分数大于a%的是
3C(g),若反应开始时充入2molA和2molB,达平衡后A的体积分数为a%。其它条件不变时,若按下列四种配比作为起始物质,平衡后A的体积分数大于a%的是
A.2mol C B.2molA、1molB和1molHe(不参加反应)
C.1molB和1molC D.2molA、3molB和3molC
14.用pH大小表示溶液的酸碱性相对强弱有许多不足之处。因此,荷兰科学家Henk Van Lubeck引入了酸度(AG)的概念,即把电解质溶液中的酸度定义为c(H+)与c(OH一)比值的对数,用公式表示为AG=lg [c(H+)/c(OH一)] 。常温下,在AG=10的溶液中能大量共存的离子是
A.Ca2+、K+、Cl- S2O32-、 B.NH4+、Fe2+、 I一、NO3-
C.Na+ 、K+、ClO-、S2- D.Na+、Cl-、SO42-、K+
13. a mol FeS与b mol FeO投入到V L、C mol•L-1的硝酸溶液中充分反应,产生NO气体,所得澄清溶液的成分可看作是Fe(NO3)3、H2SO4的混合液,则反应中未被还原的硝酸可能为
A.(a+b)×63g B.(a+b)×189g
C.(a+b)mol D.(CV-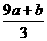 )mol
)mol
12.下列反应的离子方程式书写不正确的是
A.次氯酸钙溶液中通人少量S02气体:
Ca2++2ClO一+S02+H20=CaS03↓+2HclO
B.醋酸和碳酸氢钠溶液混合:
CH3COOH+HCO3-=CO2↑+H2O+CH3COO-
C.氯化亚铁溶液中通入氯气:2Fe2++Cl2=2Fe3++2Cl-
D.实验室制Fe(OH)3胶体:Fe3++30H一=Fe(OH)3(胶体)
11.叠氮酸(HN3)与醋酸酸性相似,下列叙述中错误的是
A.HN3水溶液中微粒浓度大小顺序为:c(HN3)>c(H+)>c(N3-)>c(OH-)
B.HN3与NH3作用生成的叠氮酸铵是共价化合物
C.NaN3水溶液中离子浓度大小顺序为:c(Na+)>c(N3-)>c(OH-)>c(H+)
D.N3-与CO2含相等电子数
10.设NA代表阿佛加德罗常数,下列说法中正确的是
①常温常压下,17g甲基(-14CH3)所含的中子数为9NA
②常温常压22.4L NO气体的分子数小于NA
③64g的铜发生氧化还原反应,一定失去2NA个电子
④7.8 g Na202中含有的阴离子数目约为6.02×1022
⑤标况时,22.4L二氯甲烷所含有的分子数为4NA
⑥1 mol金刚石中含有c-c键的数目约为6.02×1023
A.①②⑥ B.②④⑤ C.②④ D.⑤⑥
9.下列物质中不会因见光而分解的是
A.NaHCO3 B.HNO3 C.AgI D.HClO
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com