
题目列表(包括答案和解析)
3.下列各项中的“黄色”,不属于因化学反应而产生的现象的是 ( )
A.无色试剂瓶中的浓硝酸呈黄色B.在硫化钠溶液中加入双氧水后有黄色沉淀生成
C.食盐在无色的火焰上灼烧时,火焰呈黄色 D.久置的碘化钾溶液呈黄色
2.在由水电离产生的c(H+)=10-12mol·L-1的溶液中,一定能大量共存的离子组是( )
A、NH4+、Ba2+、Cl-、NO3- B、Cl-、SO42-、Na+、K+
C、SO42-、NO3-、Fe2+、Mg2+ D、Na+、K+、ClO-、I-
1、旨在限制全球温室气体排放量的《京都议定书》于2005年2月16日正式生效。为降低我国二氧化碳气体排放量(居世界第二)的下列措施中,你认为不切合实际的是 ( )
A、充分利用太阳能 B、合理、安全开发利用氢能、核能
C、因地制宜开发利用风能、水能、地热能、潮汐能
D、停止使用产生二氧化碳气体的化学能
25.(8分)有一瓶(约100mL)的硫酸和硝酸的混合液,取出10.00mL该溶液,加入足量的BaCl2溶液。充分反应后过滤、洗涤、烘干,可得4.66g沉淀。滤液和2.00mol·L-1NaOH溶液反应,共用去35.00mL碱液时恰好中和,
求:(1)混合液中H2SO4、HNO3的物质的量浓度各是多少?
(2)另取10.00mL原混合酸溶液,加入1.60g铜粉,在标准状况下可收集到多少毫升气体?
24.(4分)一块铜片投入一浓HNO3的试管中,充分反应后铜片有剩余,若将反应产生的气体用隔绝空气的方法收集,可得67.2mL(不计水蒸气)测得此气体对H2的相对密度为28,若将此气体与33.6mLO2混合后通入水中,经过足够长的时间后,水刚好充满整个容器,(气体体积均在标况下测得)
求(1)此实验中铜片减轻了 克 (2)被还原的HNO3的质量为 克
23.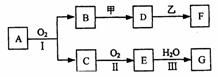 (11分)物质的转化关系如下图所示(有的反应可能在水溶液中进行)。其中A为化合物,甲可由两种单质直接化合得到,乙为金属单质,G为酸,乙在C的浓溶液中发生钝化。
(11分)物质的转化关系如下图所示(有的反应可能在水溶液中进行)。其中A为化合物,甲可由两种单质直接化合得到,乙为金属单质,G为酸,乙在C的浓溶液中发生钝化。
(1)若A为黄色固体,C能使品红试液褪色,D的水溶液中加入HNO3酸化的AgNO3溶液有白色沉淀生成。则 ①工业上反应I在 中进行,反应Ⅲ在 (均填设备名称)中进行。
②由两种单质直接化合得到甲的反应条件是 或 。
③反应I的化学方程式是 。
(2) 若甲为淡黄色固体,D、F的溶液均呈碱性,用两根玻璃棒分别蘸取A、G的浓溶液并使它们接近,有大量白烟生成。则
①甲的电子式是 。
②D的溶液与乙反应的离子方程式是 。 ③若1.7gA与O2反应生成气态的B和C时放出22.67kJ热量,写出该反应的热化学方程式:
22、(10分)麻醉剂的发现和使用,是人类医疗史上了不起的一项成就,它可使患者在接受治疗时感觉不到疼痛。
(1)笑气是人类最早应用于医疗的麻醉剂之一,它可由NH4NO3在微热条件下分解产生,产物除N2O外还有一种,此反应的化学方程式为 。有关理论认为N2O与CO2分子具有相似的结构(包括电子式),则其空间构型是 型,N2O为 分子(极性或非极性)
(2)另一种麻醉剂为乙醚(C2H5-O-C2H5),乙醚和正丁醇(C4H9OH)互为同分异构体,但两者之间沸点差异较大,其中沸点高的是(填名称)_______________,沸点高的原因是___________________________________________。
21.(12分)⑴化学工业在国民经济中占有极其重要的地位,江苏省是国内最早的硫酸生产基地之一。
①硫酸生产中,根据化学平衡原理来确定的条件或措施有 (填写序号)。
A.矿石加入沸腾炉之前先粉碎 B.使用V2O5作催化剂
C.接触室中不使用很高的温度 D.净化后炉气中要有过量的空气
E.接触氧化在常压下进行 F.吸收塔中用98.3%的浓硫酸吸收SO3
②若实验室在537℃、1.01×105Pa和催化剂存在条件下,向某密闭容器中充入1 mol SO2和0.5 mol O2,此时体积为100 L。在温度压强不变条件下反应达到平衡,SO2体积分数为0.06。若保持温度压强不变,充入1 mol SO3,则平衡时SO3的体积分数为 .
⑵室温下为液态的金属是 (填汉字名称)。电解它的一价金属的硝酸盐溶液时,阴极得到的产物是该金属的单质。当阴极消耗2 mol该盐的阳离子时,阳极可得1 mol的气体产物,则此气体的产物是 (填分子式)。由此可推断得知该盐的化学式是 ,其阴极上所发生的还原反应方程式是: 。
20.(12分)亚硝酸钠易溶于水,有碱味,有氧化性,也有还原性。NaNO2大量用于染料工业和有机合成工业中,也可用作水泥施工的抗冻剂。然而由于NaNO2有毒性,将含该物质的废水直接排放会引起水体严重污染,所以这种废水必须处理后才能排放。处理方法之一如下:
__NaNO2 + ___KI + __ _____  ___NO +__ I2 +__ K2SO4 +
__Na2SO4 +__ _____
___NO +__ I2 +__ K2SO4 +
__Na2SO4 +__ _____
(1) 根据提示,写出上述反应的离子方程式
(2)在上述反应中,若要生成50.8 g I2,则电子转移了_______________个。
(3)用上述反应来处理NaNO2并不是最佳方法,其原因是________________________________________。从环保角度来讲,要处理NaNO2,所用的物质的_________(填“氧化性”或“还原性”)应该比KI更____(填“强”或“弱”)。
(4)亚硝酸钠可以与酸反应生成亚硝酸,亚硝酸是不稳定的弱酸,它只存在于冷的稀溶液中,易发生如下分解反应:3HNO2=2NO↑+HNO3+H2O
请用两种简便的化学方法来鉴别亚硝酸钠和氯化钠。
方法一:__________________________________________________________。
方法二:__________________________________________________________。
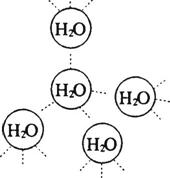
19.(9分)水是我们熟悉的物质。每个水分子都能被其他4个水分子包围形成如右图所示的四面体单元,由无数个这样的四面体再通过氢键可相互连接成一个庞大的分子晶体--冰。
(1)氢键的形成使冰的密度比水 ,氢键有方向性和饱和性,故平均每个水分子最多形成 个氢键。
(2)实验测得冰中氢键的作用能为18.8 kJ/mol,而冰的熔化热为5.0 kJ/mol,说明
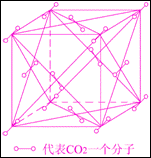 (3)干冰的外观和冰相像,可由二氧化碳气体压缩成液态后再急剧膨胀而制得。右图为干冰晶体结构示意图。通过分析,可知每个CO2分子周围与之相邻等距的CO2分子共
个。一定温度下,已测得干冰晶胞(即图示)的边长a=5.72×10-8cm,则该温度下干冰的密度为 g/cm3。
(3)干冰的外观和冰相像,可由二氧化碳气体压缩成液态后再急剧膨胀而制得。右图为干冰晶体结构示意图。通过分析,可知每个CO2分子周围与之相邻等距的CO2分子共
个。一定温度下,已测得干冰晶胞(即图示)的边长a=5.72×10-8cm,则该温度下干冰的密度为 g/cm3。
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com