
题目列表(包括答案和解析)
16.将一定体积的某NaOH溶液分成两等份,一份用pH=2的一元酸HA溶液中和,消耗酸溶液的体积为V1;另一份用pH=2的一元酸HB溶液中和,消耗酸溶液体积为V2,则下列叙述正确的是
A.若V1>V2,则说明HA的酸性比HB的酸性强
B.若V1>V2,则说明HA的酸性比HB的酸性弱
C.因为两种酸溶液的pH相等,故V1一定等于V2
D.若将两种酸溶液等体积混合,混合酸溶液的pH一定等于2
第Ⅱ卷 (非选择题共86分)
14. 在容积一定的密闭容器中,反应2A
B(g)+C(g)达到平衡后,升高温度容器内气体的密度增大,则下列叙述正确的是
在容积一定的密闭容器中,反应2A
B(g)+C(g)达到平衡后,升高温度容器内气体的密度增大,则下列叙述正确的是
A.正反应是吸热反应,且A不是气态
B.正反应是放热反应,且A是气态
C.其他条件不变,加入少量C,该平衡向逆反应方向移动
D.改变压强对该平衡的移动无影响
15 已知反应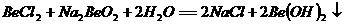 能完全进行,则下列推断中,正确的是
( )
能完全进行,则下列推断中,正确的是
( )
A. 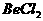 溶液的pH<7,将其蒸干并灼烧后,得到的残留物可能为BeO
溶液的pH<7,将其蒸干并灼烧后,得到的残留物可能为BeO
B. 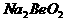 溶液的pH>7,将其蒸干并灼烧后,得到的残留物可能为BeO
溶液的pH>7,将其蒸干并灼烧后,得到的残留物可能为BeO
C. 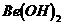 既能溶于盐酸又能溶于烧碱溶液
既能溶于盐酸又能溶于烧碱溶液
D. 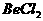 水溶液的导电性强,因此
水溶液的导电性强,因此 一定是离子化合物
一定是离子化合物
13.下列叙述中,正确的是( )
A.含金属元素的离子不一定都是阳离子
B.在氧化还原反应中,非金属单质一定是氧化剂
C.某元素的化合态变为游离态时,该元素一定被还原
D.金属阳离子被还原不一定得到金属单质
12..已知溶质的质量分数为95%酒精溶液的物质的量浓度为16.52 mol·L-1,试判断溶质质量分数为47.5%酒精溶液的物质的量浓度为 ( )
A.小于8.26 mol·L-1 B.等于8.26 mol·L-1
C.大于8.26 mol·L-1 D.无法判断
9.设NA表示阿伏加德罗常数,下列叙述中正确的是 ( )
A、1mol金刚石晶体中含碳碳键数为2 NA
B、常温常压下,22.4L的D2、H2组成的气体分子数约为NA
C、标准状况下,22.4LSO3中含有的氧原子数约为3 NA
D、1molNa2O2与足量CO2反应转移的电子数NA
10有乙离子存在时,欲用试剂丙来检验溶液中是否含有甲离子,在只有试管和滴管情况下,下表所加试剂丙能够对甲离子进行成功检验的是
|
选 项 |
试 剂 丙 |
甲离子 |
乙离子 |
|
A |
稀盐酸酸化的Ba(NO3)2溶液 |
SO42- |
SO32- |
|
B |
AgNO3溶液 |
Cl- |
I- |
|
C |
KSCN溶液 |
Fe2+ |
Fe3+ |
|
D |
稀氨水 |
Al3+ |
Ag+ |
11下列有关物质性质的比较正确的是
A、元素的最高正化合价在数值上等于它所在的族序数
B、同周期主族元素的原子半径越小,越难失去电子
C、还原性:S2->Se2->Br->Cl-
D酸性:HClO4>H2SO4>H3PO4>H2SiO3
8. 下图表示反应A(气)+B(气)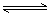 nC(气);△H<0在不同条件下反应混合物中C的百分含量和反应过程所需时间的关系曲线。下列有关叙述正确的是( )
nC(气);△H<0在不同条件下反应混合物中C的百分含量和反应过程所需时间的关系曲线。下列有关叙述正确的是( )
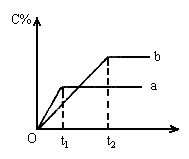
A. 若其它条件相同,a比b的温度
B. a表示有催化剂,b表示无催化剂
C. 若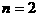 ,其它条件相同,a比b的压强大
,其它条件相同,a比b的压强大
D. 反应由逆反应开始 t
7. 航天技术上使用一种氢氧燃料电池,它具有高能轻便、不污染环境等优点,该电池总反应方程为: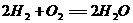 ,该电池的正极反应可表示为 ( )
,该电池的正极反应可表示为 ( )
A. 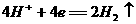 B.
B. 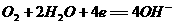
C. 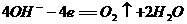 D.
D. 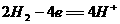
6. 下列离子方程式不正确的是 ( )
A. 向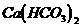 溶液中滴入少量NaOH溶液
溶液中滴入少量NaOH溶液
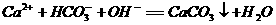
B. 等体积、等物质的量浓度的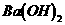 和
和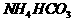 溶液混合
溶液混合
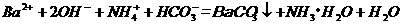
C. 向 溶液中通入过量
溶液中通入过量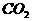
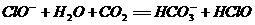
D. 向100 mL
1 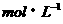 的
的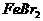 溶液中通入
溶液中通入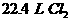 (标况下)
(标况下)

5.常温下分别将下列各组中的两种溶液等体积混合,所得溶液pH一定等于7的是
A、0.1mol/L的某一元酸和0.1mol/L的某一元碱
B、0.1mol/L的某二元强酸和0.1mol/L的某二元碱
C、pH=2的某一元酸和pH=12的某一元碱
D、pH=3的某二元强酸和pH=11的某一元强碱
4.下列事实不能用勒夏特列原理解释的是 ( )
A、开启啤酒瓶后,瓶中马上泛起大量泡沫
B、工业生产硫酸的过程中使用过量的氧气,以提高二氧化硫的转化率
C、实验室中常用排饱和食盐水的方法收集氯气
D、由H2、I2(g)、HI组成的平衡体系,加压后颜色加深
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com