
题目列表(包括答案和解析)
⒔⑴( )
⑵ (填一种物质的化学式), (填一种物质的化学式)。
⑶① ②
③ mol/L(液体的体积变化忽略不计)。
⑷ 。
⑸ 。
⒕(1)
(2)
(3)
(4)
(5)
⒖(1) 。
(2) 。
(3) 。
(4) 。
⒔下表是元素周期表的一部分,表中所列的字母分别代表某一化学元素元素。请回答下列下列问题:
|
a |
|
|||||||||||||||
|
|
b |
|
|
|
c |
d |
|
|||||||||
|
e |
n |
f |
|
|
g |
h |
||||||||||
|
|
|
|
|
|
|
|
m |
|
|
|
|
|
|
|
|
|
⑴下列叙述正确的是 ( )
A.n的碳酸盐能溶于水或盐酸
B.硒化氢的还原性和稳定性强于g的氢化物的还原性和稳定性。
C.e与g形成的化合物水溶液的pH大于e与h形成的化合物水溶液的pH,说明同浓度氢化物水溶液的酸性g弱于h
D.a、c、e、n四种元素的原子半径大小为n>e>c>a
⑵由a、c和d三种元素形成的化合物中,能促进水电离的是 (填一种物质的化学式),能抑制水电离的是 (填一种物质的化学式)。
⑶f、e元素的单质共10.0g在200mL水中完全溶解,生成的溶液中只含有一种溶质(不考虑因水解反应产生的物质),分步写出发生反应的化学方程式:
① ②
③所得溶液的物质的量浓度为 (液体的体积变化忽略不计)。
⑷写出工业上电解由e和h所形成化合物的水溶液的反应方程式: 。
⑸f单质与m的一种红棕色氧化物反应化学方程式: 。
⒕已知A、B、C、D、X、Y六种物质均由短周期元素组成,其中X为常见离子化合物,它们之间的转换关系如下图所示
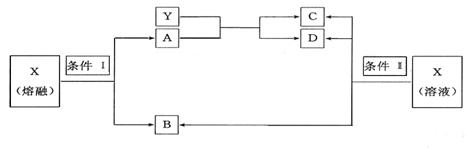
(1)已知条件I和条件II相同,则该反应条件为
(2)物质X的电子式为
(3)写出B与Ca(OH)2反应的化学方程式
(4)写出X在条件II下反应生成B、C、D的离子方程式
(5)写出实验室制B的化学方程式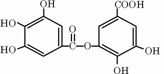
⒖我国盛产五倍子。以五倍子为原料可制得化合物A。
A的结构简式如右图所示:
请解答下列各题:
(1)A的分子式是 。
(2)有机化合物B在硫酸催化条件下加热发生酯化反应可得到A。请写出B生成A的化学方程式: 。
(3)请写出A与过量NaOH溶液反应的化学方程式: 。
(4)有机化合物C是合成治疗禽流感药物的原料之一。C可以看成是B与氢气按物质的量之比1︰2发生加成反应得到的产物。C分子中无羟基与碳碳双键直接相连的结构,它能与溴水反应使溴水褪色。请写出C的结构简式: 。
秀水高级中学第六次月考
高三化学答题卷
⒈在生活中学习化学,在化学学习中思考生活。人的血液正常时呈弱碱性,血液显弱碱性的原因是血液中存在着
A.Cl- B.HCO3- C.Ca2+ D.Na+
 ⒉实验要知其所以然。将铜片和锌片用导线连接后
⒉实验要知其所以然。将铜片和锌片用导线连接后
插入番茄里,如图所示,电流计指针发生偏转,锌片是
A.阳极 B.正极
C.阴极 D.负极
⒊ClO2是一种广谱型的消毒剂,根据世界环保联盟的要求ClO2将逐渐取代Cl2成为生产自来水的消毒剂。工业上ClO2常用NaClO3和Na2SO3溶液混合并加H2SO4酸化后反应制得,在以上反应中NaClO3和Na2SO3的物质的量之比为
A.1︰1 B.2︰1 C.1︰2 D.2︰3
⒋右图是温度和压强对X + Y  2Z 反应影响的示
2Z 反应影响的示
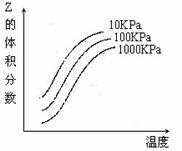 意图。图中横坐标表示温度,纵坐标表示平衡混合气
意图。图中横坐标表示温度,纵坐标表示平衡混合气
体中Z的体积分数。下列叙述正确的是
A.上述可逆反应的正反应为放热反应
B.X、Y、Z均为气态
C.X和Y中只有一种是气态,Z为气态
D.上述反应的逆反应的△H>0
⒌把Ba(OH)2溶液滴入明矾溶液中,使SO42-全部转化为BaSO4沉淀,此时铝元素的主要存在形式是
A.Al3+ B.Al(OH)3 C.AlO2- D.Al3+和Al(OH)3
⒍下列离子中,所带电荷数与该离子的核外电子层数相等的是 A.Al3+ B.Mg2+ C.Be2+ D.H+
⒎A、B、C、D四种短周期元素的原子半径依次减小,A与C的核电荷数之比为3∶4,D能分别与A、B、C形成电子总数相等的分子X、Y、Z。下列叙述正确的是
A.X、Y、Z的稳定性逐渐减弱
B.A、B、C、D只能形成5种单质
C.X、Y、Z三种化合物的熔沸点逐渐降低
D.自然界中存在多种由A、B、C、D四种元素组成的化合物
⒏关于下列各装置图的叙述中,不正确的是
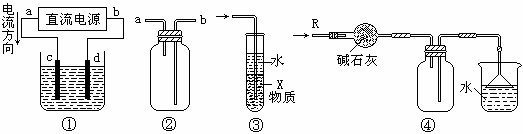
A.装置①中,d为阳极、c为阴极
B.装置②可用于收集H2、NH3、CO2、Cl2、HCl、NO2等气体
C.装置③中X若为四氯化碳,可用于吸收氨气或氯化氢,并防止倒吸
D.装置④可用于干燥、收集氨气,并吸收多余的氨气
⒐等质量的CuO和MgO粉末分别溶于相同体积的足量硝酸中,得到的Cu(NO3)2和Mg(NO3)2溶液的浓度分别为amol·L-1和bmol· L-1。则a与b的关系为
A.a=b B.a=2b C.2a=b D.a=5b
⒑下列离子方程式中正确的是
A.H2SO4与Ba(OH)2溶液反应:Ba2++2OH-+2H+十SO42-=BaSO4↓+2H2O
B.Ca(HCO3)2与过量Ca(OH)2溶液反应:Ca2++HCO3-+2OH-=CaCO3↓+ CO32-+2H2O
C.NaOH溶液中通入少量CO2: OH-+ CO2=HCO3-
D.CH3COOH溶液与NaOH溶液反应: H++ OH-=H2O
⒒天然维生素P(结构如图)存在于槐树花蕾中,
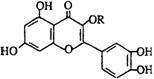 它是一种营养增补剂。关于维生素P的叙述错误的是
它是一种营养增补剂。关于维生素P的叙述错误的是
A.可以和溴水反应
B.可用有机溶剂萃取
C.分子中有三个苯环
D.1mol维生素P可以和4molNaOH反应
⒓在100mL含等物质的量的HBr和H2SO3的溶液里通入0.01mol Cl2,有一半Br-变为Br2(已知Br2能氧化H2SO3)。原溶液中HBr和H2SO3的浓度都等于:
A、0.0075mol•L-1 B、0.008mol•L-1 C、0.075mol•L-1 D、0.08mol•L-1
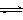 24(10分)在537℃、1.01×105Pa时,往容积可变的密闭容器中充入1molX和3molY,此时容积为VL。保持恒温恒压,发生反应X(g)+ 3Y(g) + 2Z(g),达到平衡时,平衡混合气体中Z的体积分数为0.5。
24(10分)在537℃、1.01×105Pa时,往容积可变的密闭容器中充入1molX和3molY,此时容积为VL。保持恒温恒压,发生反应X(g)+ 3Y(g) + 2Z(g),达到平衡时,平衡混合气体中Z的体积分数为0.5。
(1)达到平衡时,X的转化率约为 。
(2)保持上述温度和压强恒定不变,若向容器中只充入4molZ,则反应达到平衡时,平衡气体中Y的体积分数为 ,容器的容积为 L。
(3)若另选一容积固定不变的密闭容器,仍控制温度不变,使2molX和6molY反应,达到平衡时平衡气体中Z的体积分数仍为0.5,则该密闭容器的容积为 。
(4)若温度仍为537℃,容器体积保持VL不变(恒容),往其中充入a mol X的b mol Y,使反应达到平衡,这时平衡气体中Z的体积分数仍为0.5,体系压强为1.01×105Pa,若a : b = 1 : 3,则a= 。
25(10分)往200mL NaOH溶液中通入CO2,充分反应后,在减压和低温下,小心将溶液蒸干,得白色固体M。通入CO2的体积V(CO2) (mL)(标准状况下)与M的质量(g)的关系如图。试通过分析和计算回答下列问题(要求写出简要计算过程):
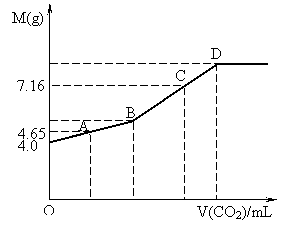

(1)B点时,白色固体M的化学式_________,通入CO2的体积为______________mL。
(2)D点时,通入CO2的体积为__________mL。
(3)C点时,通入CO2的体积为__________mL。
 (4)取组成为A点的白色固体
(4)取组成为A点的白色固体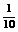 ,向其中逐滴加入0.1mol/LHCl溶液,请在下图中画出产生CO2气体体积(标准状况下)与所加入的盐酸的体积关系:
,向其中逐滴加入0.1mol/LHCl溶液,请在下图中画出产生CO2气体体积(标准状况下)与所加入的盐酸的体积关系:
23.(10分)有A、B、C、D、E、F六种元素,已知:它们位于三个不同短周期,核电荷数依次增大;A与E、B与F分别同主族;A、E分别都能与D按原子个数比1﹕1或2﹕l形成化合物;B、C分别都能与D按原子个数比1﹕1或1﹕2形成化合物。
⑴写出只含有A、B、D、E四种元素的两种无水化学式 、 。
⑵右图是A与D形成的一种化合物的晶体结构示意图,其中的虚线表示
,与每个“构 成粒子”相邻的粒子呈
空间构型。
成粒子”相邻的粒子呈
空间构型。
E与D按原子个数比1﹕1形成的化合物与水反应的离子方程式为 。
⑶人们通常把拆开l mol某化学键所吸收的能量看成该化学键的键能。键能的大小可以衡量化学键的强弱,也可以用于估算化学反应的反应热(△H),化学反应的△H等于反应中断裂旧化学键的键能之和与反应中形成新化学键的键能之和的差。下表列出了上述部分元素形成的化学键的键能:
|
化学键 |
F-D |
F-F |
B-B |
F-B |
C═D |
D═D |
|
键能/kJ·mol-1 |
460 |
176 |
347.7 |
347 |
745 |
497.3 |
①下列三种物质形成的晶体,熔点由高到低的顺序(用a、b、c表示):
a.F与B形成的化合物 b.B与D形成的稳定化合物 c.F的单质
②试估算F单质晶体的燃烧热: 。
21.(7分)2000年美国《科学》杂志报道,意大利科学家合成了一种新型氧分子,它是由4个氧原子构成的O4分子,专家认为它液化后的能量密度比普通氧分子高得多。O4分子的结构如下图所示,是平面型分子,键角为120°。四个氧原子以一个O原子为中心,与另外三个O原子分别构成一个非极性共价键;中间O原子提供三个电子,周围三个O原子各提供1个电子,构成一个特殊的化学键--四个O原子均等地享有这6个电子,请回答:
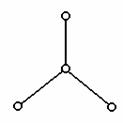
(1)O4固体属于____________晶体(填“原子”、“离子”、“分子”、“金属”)
(2)O4与氧气的关系是__________,它们之间的转化是否为氧化还原反应_________(填是或否)。
(3)O4具有强氧化性,能将 氧化为
氧化为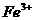 ,试配平:(提示:在相同温度和压强下,反应前后气体体积不变)
,试配平:(提示:在相同温度和压强下,反应前后气体体积不变)
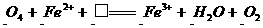
在该反应中,当生成1 molO2,转移电子的物质的量为________ mol。
22(8分)A、B、C、D、E都是短周期元素,原子序数依次增大,A、B处于同一周期,C、D、E同处另一周期。C、B可按原子个数比2∶l和1∶1分别形成两种离子化合物甲和乙。D、A按原子个数比3∶2形成离子化合物丙。E是地壳中含量最高的金属元素。根据以上信息回答下列问题:
(1)B元素在周期表中的位置是____________,乙物质的电子式是____________·
(2)A、B、C、D、E五种元素的原子半径由小到大的顺序是____________(用元素符号填写)。
(3)E的单质加入到C的最高价氧化物对应的水化物的溶液中,发生反应的离子方程式是___________。
20.(13分)已知A、B均是由两种元素组成的化合物,A中某种元素的质量分数为75% ,B是一种淡黄色固体,C、J是同周期元素的气态氢化物,其中C是含氢量最高的烃,X为无色液体。反应生成的水均已略去。它们有如下图所示的关系。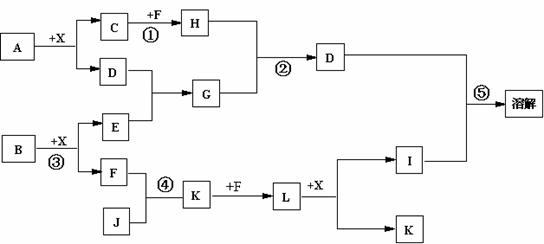
(1)写出化学式:A B J 。
(2)反应③中每生成1molF,转移电子的数目为: 。
(3)反应④的化学方程式为: 。
(4)写出离子方程式分别为:
反应② ;⑤ 。
(5)反应①中,每1.00gC与足量的F作用,恢复到25oC放出55.6kJ热量,写出反应①的热化学方程式 。
19.(8分)试用离子方程式表示下列各变化
(1)将FeCl3饱和溶液滴入到沸水中 ;
(2)向(1)所得的混和物中逐滴加入盐酸: ;
其现象是 。
(3)向FeCl3溶液中滴加KSCN溶液,溶液呈血红色;若向FeCl3溶液中先加入NaF,再加入KSCN则看不到溶液呈红色,其原因不可能是 (填序号,多选倒扣分)
A、Fe3+强氧化性将F-氧化
B、Fe3+与F-形成复杂的稳定的化合物
C、Fe3+与F-发生反应转化为Fe (OH)3沉淀
(4)若向FeCl3溶液中先加入足量的HCl,再加入NaF和KSCN,则仍能显血红色,其原因是 。
18.(11分)我国化工专家侯德榜的“侯氏制碱法”曾为世界制碱工业做出了突出贡献。他利用NaHCO3、NaCl、NH4C1等物质溶解度的差异,以食盐、氨气、二氧化碳等为原料先制得NaHCO3,进而生产出纯碱。下面是在实验室中模拟“侯氏制碱法”制取NaHCO3的实验步骤:第一步:连接好装置,检验气密性,在仪器内装入药品。第二步:先让一装置发生反应,直到产生的气体不能再在C中溶解时,再通入另一装置中产生的气体,片刻后,C中出现固体。继续向C中通入两种气体,直到不再有固体产生。第三步:过滤C中所得的混合物,得到NaHCO3固体。第四步:向滤液中加入适量的NaCl粉末,有NH4C1晶体析出。……请回答下列问题:
(1)装置的连接顺序是:(a)接( ) ( )接( ); (b)接( )
(2)A中常选用的固体反应物为 ;D中应选用的液体为 ;B中发生反应的化学方程式为 。
(3)第二步骤中必须先让 装置先发生反应。
(4)C中用球形干燥管而不用直导管,其作用是 ,C中广口瓶内产生固体的总化学方程式为 。
(5)第四步中分离出NH4C1晶体的操作是 ;其所得的NH4C1晶体中常含有少量的NaCl和NaHCO3约占5%~8%),请设计一个简单的实验证明所得固体的成分大部分是NH4Cl。简要写出操作和现象:
17.(1)(4分)下列有关实验的叙述,不正确的是(填序号)
A、为检验酸性溶液中的Cl-和SO42-,先加硝酸银溶液,滤去沉淀后加硝酸钡溶液
B、用渗析法分离淀粉中混有的NaCl杂质
C、点燃可燃性气体时,都要先检验气体纯度,后点燃。
D、用酸式滴定管量取20.00mL高锰酸钾溶液
E、为了测定某溶液的pH,将未经湿润的pH试纸浸入到待测溶液,过一会取出,与标准比色卡进行对比
F、皮肤上沾有少量浓硫酸,可立即用大量水冲洗
G、足量Cl2通入FeCl2溶液后,将溶液蒸干并灼烧,可得到Fe2O3
H、用瓷坩埚高温熔融Fe(CrO2)2和Na2CO3的固体混合物
J、用结晶法可以除去硝酸钾中混有的少量氯化钠
(2)(5分)被称为“魔棒”的荧光棒已成为节日之夜青少年的喜爱之物,其发光原理是利用过氧化氢氧化草酸酯产生能量,该能量被传递给荧光物质后便发出荧光.回答下列问题:
①有人说,发光的魔棒不能凑近石油气之类的可燃性气体,否则会导致爆炸,是否正确?说明理由。 。
②通过挤压,使过氧化氢与草酸酯混合反应,导致魔棒发光,一段时间后,光的亮度降低,此时,把魔棒往手心上敲打几下,亮度会重新增大,原因是什么?(提示:草酸酯是一种有较高粘度的有机化合 物) 。
③在设计魔棒时,其连续发光的能力在8-12h,如果在发光中途,把它放入冰箱的冷冻室中,发光便会停止或基本停止.把魔棒从冷冻室中取出静止一会儿,它又会连续发光,原因产什么?
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com