
题目列表(包括答案和解析)
15.(一)(1)2NH4Cl+Ca(OH)2 △ CaCl2+2NH3↑+2H2O (2分)
(2)氢氧化钠固体(或生石灰或碱石灰) (1分)
21A.(物质结构与性质,12分)A、B、C、D分别代表四种不同的元素。A原子的最外层电子排布为ns1,B原子的价电子排布为ns2np2,C原子的最外层电子数是其电子层数的3倍,D原子的L电子层的p轨道有3个电子。
(1)C原子的电子排布式为 ▲ ,若A原子的最外层电子排布为1s1,则按原子轨道的重迭方式判断,A与C形成的化合物中的共价键类型属于 ▲ ,A与C所形成的化合物的熔沸点明显高于A与C的同主族元素所形成的化合物的熔沸点,其原因是 ▲ 。
(2)当n=2时,B原子的结构示意图为 ▲ ,B与C形成的晶体属于 晶体。当n=3时,B与C形成的晶体中,B原子的杂化方式为 ▲ ,该晶体中最小的环共有 ▲ 个微粒构成,微粒间的作用力是 ▲ 。
(3)若A原子的最外层电子排布为4s1,B原子的价电排布为3s23p2,A在元素周期表中的位置是 ▲ ,A、B、C、D四种元素的第一电离能由大到小的顺序是
▲ (用元素符号表示)。
21B.(实验化学,12分)某化学研究性学习小组进行了一系列“带火星的木炭复燃”的实验,实验装置如下图所示。
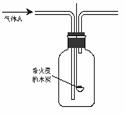 (1)甲组同学探究“使带火星木炭复燃时O2的体积分数的极限”。将氧气和空气(假定空气中O2的体积分数为20%)按不同的体积比混合得100mL气体A进行实验,实验记录如下:
(1)甲组同学探究“使带火星木炭复燃时O2的体积分数的极限”。将氧气和空气(假定空气中O2的体积分数为20%)按不同的体积比混合得100mL气体A进行实验,实验记录如下:
|
编号 |
I |
II |
III |
IV |
V |
|
V(O2)/mL |
60 |
40 |
20 |
12 |
10 |
|
V(空气)/mL |
40 |
60 |
80 |
88 |
90 |
|
现象 |
木炭复燃 |
木炭复燃 |
木炭复燃 |
木炭有时燃烧,有时不燃烧 |
木炭 不复燃 |
回答下列问题:
①使带火星木炭复燃的O2的体积分数最小约为 ▲ 。
②用带火星木炭检验集气瓶里是否集满O2,若木炭复燃,能否认为集气瓶里的气体一定是纯净的O2?答: ▲ (填“能”或“否”)。
③若按照3∶2的比例混合O2和CO2气体,该混合气体能否使带火星的木炭复燃?
答: ▲ (“能”、“否”或“不一定”)。
(2)乙组同学探究“NO2能否支持燃烧”的问题,设计了如下几组实验,实验记录及结论如下:
|
编号 |
制取气体A(下列反应产生的混合气体) |
B中的现象 |
结论 |
|
a |
在烧瓶中加热适量浓HNO3 4HNO3 △ 4NO2↑+O2↑+2H2O↑ |
充满红棕色气体,木炭不复燃,火星熄灭 |
NO2不支持燃烧 |
|
b |
加热AgNO3固体 2AgNO3 △ 2NO2↑+O2↑+2Ag |
充满红棕色气体,木炭复燃 |
NO2支持燃烧 |
|
c |
加热Cu(NO3)2固体 2Cu(NO3)2 △ 4NO2↑+O2↑+2CuO |
充满红棕色气体,木炭复燃 |
NO2支持燃烧 |
你认为a、b、c三个结论是否可靠?说出你的理由。
a. ▲ ,原因是 ▲ 。
b. ▲ ,原因是 ▲ 。
c. ▲ ,原因是 ▲ 。
高三化学期未考试答案及评分标准
20.(10分)工业生产粗硅的主要原理为:SiO2+2C 3273K Si(粗)+2CO↑。
(1)若在制粗硅的过程中同时生成了碳化硅,且生成的硅和碳化硅的物质的量之比为5∶1,则参加反应的C和SiO2的质量比为 ▲ 。
(2)工业上可通过如下流程由粗硅制取纯硅:
|
|||||
|
|
||||


 Si(粗)
SiCl4(l)
Si(纯)
Si(粗)
SiCl4(l)
Si(纯)
若上述反应中Si(粗)和SiCl4的利用率均为80%,制粗硅时有10%的SiO2转化为SiC,则生产100.8t纯硅需纯度为75%的石英砂多少吨?
(3)工业上还可以通过下图所示的流程来制取纯硅:
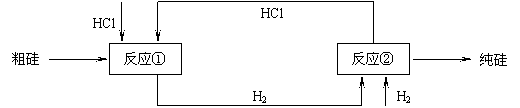
反应①: Si(粗)+3HCl(g) 553~573K SiHCl3(l)+H2(g)
反应②: SiHCl3+H2 1373K Si(纯)+3HCl
假设在每一轮次的投料生产中,硅元素没有损失,反应①中HCl的利用率为75%,反应②中H2的利用率为80%,则在下轮次的生产中,需补充投入HCl和H2的体积比为多少?
19.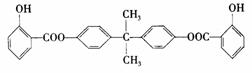 (12分)利用芳香烃X和链烃Y可以合成紫外线吸收剂BAD,BAD的结构简式为:
(12分)利用芳香烃X和链烃Y可以合成紫外线吸收剂BAD,BAD的结构简式为:
BAD的合成路线如下(已知G不能发生银镜反应):
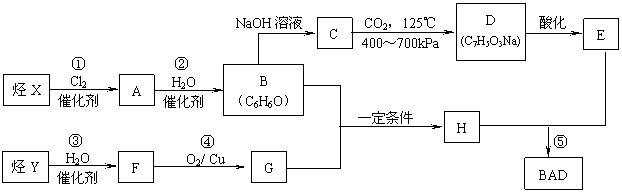
试回答下列问题:
(1)写出结构简式:Y______▲_____;D_______▲______。
(2)属于取代反应的有_____▲______(填数字序号)。
(3)1 mol BAD最多可与含_______▲_____mol NaOH的溶液完全反应。
(4)写出下列反应的化学方程式:
反应④: ▲ ;
B+G→ H: ▲ 。
18.(10分)居室是我们日常生活中最重要的场所。现代人在“煤烟型”、“光化学烟雾”污染后,正在进入以“室内空气污染”为标志的第三污染时期。造成室内环境污染的有毒物质主要有甲醛、苯、氨、氡四种。
请回答下列问题:
(1)氨分子的电子式是 ▲ ,苯分子的空间构型为 ▲ 。
(2)提出减少室内空气污染的一条措施: ▲ 。
(3)我国《室内空气质量标准》规定室内空气中甲醛含量不得超过0.08mg•m-3,甲醛测定的方法主要有分光光度法、色谱法、电化学法、化学滴定法等。某校研究性学习小组的同学拟采用化学滴定法对教室内空气中甲醛的含量进行测定,如果你参与该研究课题,你采集甲醛样品的方法是 ▲ 。
(4)碘量法是化学滴定法之一。碘量法原理为在碱性介质(NaOH)中,碘转化为次碘酸钠和碘化钠,次碘酸钠将溶液中游离的甲醛氧化为甲酸钠;经适当酸化后,剩余的次碘酸钠与碘化钠又生成碘;以淀粉为指示剂,用硫代硫酸钠标准溶液滴定。上述过程中涉及的化学反应的离子方程式依次为I2+2OH-====IO-+I-+H2O、 ▲ 、 ▲ 、I2+2S2O32-====S4O62-+2I-。实验过程中需要测定的数据除总碘量外,还有 ▲ 。
17.(10分)我国规定饮用水质量标准必须符合下列要求:
|
pH |
6.5-8.5 |
|
Ca2+、Mg2+总浓度 |
<0.0045mol·L-1 |
|
细菌总数 |
<100个/mL |
某综合实践活动小组到自来水厂进行参观,了解到源水处理成自来水的工艺流程示意
图如下: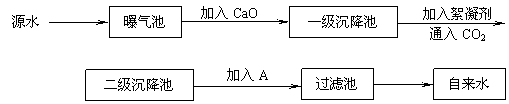
(1)源水中含Ca2+、Mg2+、HCO3-、Cl-等,加入CaO后生成,进而发生若干个化学反应,请写出其中任意一个反应的离子方程式 ▲ 。
(2)加入絮凝剂可以除去其中的悬浮固体颗粒,该过程是 ▲ (填写序号)。
①只有物理过程,无化学过程
②只有化学过程,无物理过程
③既有物理过程,又有化学过程
(3)FeSO4·7H2O是常用的絮凝剂,加入后最终生成红褐色胶状沉淀,则这种沉淀是 ▲ (填写化学式)。
(4)通入二氧化碳的目的是 ▲ 和 ▲ 。
(5)物质A的作用是 ▲ ,则A可以选择下列物质中的 ▲ (填写序号)。
①ClO2 ②SO2 ③液氯 ④Ca(ClO2)2 ⑤浓硫酸
16.(8分)(1)蕴藏在海底的“可燃冰”是在高压下形成的外观像冰的甲烷水合物固体,我国南海海底有极其丰富的“可燃冰”资源。将“可燃冰”从海底取出时易融化,释放出的甲烷气体将泄漏于大气中而产生严重的环境问题,这是目前开采“可燃冰”遇到的技术难题,请据此回答:
①甲烷气体泄漏于大气中会造成怎样的环境问题?答: ▲ 。
②请你运用所学的物质结构知识解释“可燃冰”为何易融化放出气体?答: ▲ 。
(2)设计出燃料电池使液化石油气氧化直接产生电流是新世纪最富有挑战性的课题之一。最近有人设计了一种燃料电池,一个电极通入空气,另一个电极通入液化石油气(以C4H10表示),电池的电解质是掺杂了Y2O3的ZrO2晶体,它在高温下能传导O2-。
①已知该电池的负极反应为:C4H10+13O2--26e- 4CO2+5H2O,则该电池的正极反应式为 ▲ ,电池工作时,固体电解里的O2-向 ▲ 极移动。
②液化石油气燃料电池最大的障碍是氧化还原不完全而产生的 ▲ (填写物质的名称)堵塞电极的通气管道。
(3)能源的紧缺在很大程度上制约了我国的经济发展,请你提出解决能源紧缺问题的两点建议:
① ▲ ,② ▲ 。
(三)问题讨论
(1)有同学认为:NH3与CuO反应生成的红色物质中可能含有Cu2O。已知Cu2O是红色粉末,是一种碱性氧化物,在酸性溶液中,Cu+能自身发生氧化还原反应生成Cu2+和Cu。请你设计一个简单的实验检验该红色物质中是否含有Cu2O: ▲ 。
(2)在解决了问题(1)后,又有同学提出:Cu2O与CuO的热稳定性哪个更强?于是他们进行了如下实验:取98 g Cu(OH)2固体,加热到80℃~100℃时,得到黑色固体粉未,继续加热到1000℃以上,黑色粉未全部变成红色粉未A。冷却后称量,A的质量为72 g。据此可推得A为 ▲ ,由此得到的结论是 ▲ 。
(二)实验探究
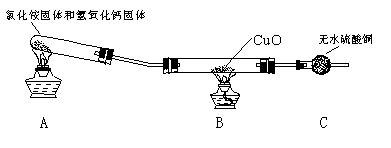 该小组成员设计实验探究氨气还原性及其产物,实验装置(夹持及尾气处理装置未画出)图如下:
该小组成员设计实验探究氨气还原性及其产物,实验装置(夹持及尾气处理装置未画出)图如下:
(1)该装置在设计上有一定的缺陷,为确保实验结果的准确性,你对该装置的改进措施是 ▲ 。
(2)利用改进后的装置进行实验,观察到CuO变为红色物质,无水CuSO4变蓝,同时生成一种无污染的气体。请写出NH3与CuO反应的化学方程式 ▲ 。
(一)制取氨气
(1)实验室常用加热氯化铵固体和氢氧化钙固体的混合物来制取氨气,写出反应的化学方程式 ▲ 。
(2)实验室还可在 ▲ (填一种试剂)中滴加浓氨水的方法快速制取少量氨气。
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com