
题目列表(包括答案和解析)
13.可逆反应m A(g) + n B(g) pC(g) + g D(g) 的v - t图像如下左图,若其它条件都不变,只是在反应前加入合适的催化剂,则其v - t 图像如下右图。
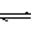
①a1 = a2 ② a1 < a2 ③b1 = b2 ④b1 < b2 ⑤t1 > t2
⑥t1 = t2 ⑦两图中阴影部分面积相等 ⑧右图阴影部分面积更大
以上正确的为
A.②④⑤⑦ B.①④⑥⑧ C.②③⑤⑧ D.①③⑥⑦
12.某研究性学习小组为了探索镁粉与溴水反应的机理,做了如下四组实验:
①将镁粉投入冷水中,未见任何现象;
②将镁粉放入溴水中,观察到只是开始时产生极少量的气泡,但溴水的颜色逐渐褪去;
③将镁粉放入液溴中,未观察到任何明显现象;
④向含足量镁粉的液溴中滴加几滴水,观察到溴的红棕色很快褪去。
则下列关于镁与溴水的反应机理的论述中正确的是
A.镁粉只直接与溴水中的溴反应
B.镁粉只与溴水中的酸反应
C.产生极少量的气泡是由于镁粉与水反应得到
D.镁粉在水的催化下与溴发生反应
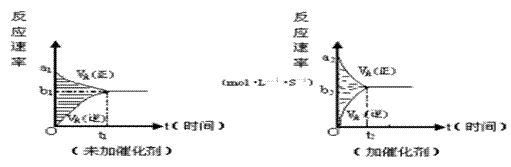
10。 如图所示,夹子开始处于关闭状态,将液体A滴人试管②与气体B充分反应,打开夹子,可发现试管①内的水立刻沸腾了。则液体A和气体B的组合不可能是下列的
A.氢氧化钠溶液、二氧化碳
B.水、氨气
C.氢氧化钠溶液、一氧化氮
D.水、二氧化氮
11.下列实验操作中,错误的是
如图所示,夹子开始处于关闭状态,将液体A滴人试管②与气体B充分反应,打开夹子,可发现试管①内的水立刻沸腾了。则液体A和气体B的组合不可能是下列的
A.氢氧化钠溶液、二氧化碳
B.水、氨气
C.氢氧化钠溶液、一氧化氮
D.水、二氧化氮
11.下列实验操作中,错误的是
(1)用托盘天平称取5.2gNaCl ;(2)用50mL量筒量取5.2mL盐酸;(3)用蒸发皿加热KNO3溶液制取KNO3晶体;(4)用100mL容量瓶配制50mL0.1mol/LH2SO4溶液;(5)用带玻璃塞的棕色试剂瓶存放浓HNO3;(6)用煤油液封保存锂、钠、钾单质
A.(2)(3)(5) B.(2)(4)(5) C.(1)(4)(6) D.(2)(4)(6)
9.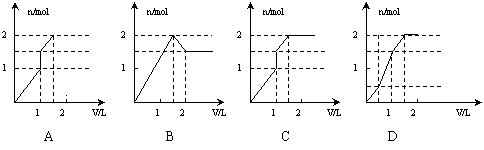 向含1mol HCl和1mol MgSO4的混合溶液中加入1mol·L-1的Ba(OH)2溶液,产生沉淀的物质的量(n)与加入Ba(OH)2溶液体积(V)间的关系图正确的是
向含1mol HCl和1mol MgSO4的混合溶液中加入1mol·L-1的Ba(OH)2溶液,产生沉淀的物质的量(n)与加入Ba(OH)2溶液体积(V)间的关系图正确的是
8、下列离子方程式或化学方程式,正确的是
A、澄清石灰水中加入少量小苏打溶液: Ca2++OH-+HCO3-=CaCO3↓+H2O
B、氯化铁溶液中通入硫化氢气体: 2Fe3++3S2-=2FeS↓+S↓
C、向Fe(OH)3中加入氢碘酸:Fe(OH)3+3H+=Fe3++3H2O
D、氯化铝溶液中加入过量氨水:4NH3·H2O+Al3+=4NH4++AlO2-+2H2O
7.在元素周期表短周期中的X和Y两种元素可组成化合物XY3,下列说法正确的是( )
A.XY3晶体一定是离子晶体
B.若Y的原子序数为m,X的原子序数不可能是m±4
C.X和Y可属于同一周期,也可属于两个不同周期
D.X和Y一定不属于同一主族
6、NA为阿伏加德罗常数,下列说法正确的是
A、1molFe3+完全水解生成氢氧化铁胶体粒子的数目为NA
B、常温常压下,32gO2-离子中所含电子的数目为17 NA
C、标准状况下,11.2 L四氯化碳所含分子数为0.5 NA
D、含有2NA个阴离子的Na2O2固体,投入足量水中产生约22.4L的氧气
5.下列各组热化学方程式(同温、同压下)中Q1大于Q2(Q1、Q2为正值)的有
①:S(g)+O2(g)=SO2(g); ΔH=-Q1kJ/moL
S(s)+O2(g)=SO2(g); ΔH=-Q2kJ/moL
②:C(s)+1/2 O2(g)=CO(g); ΔH=-QlkJ/moL
C(s)+O2(g)=CO2(g); ΔH=-Q2kJ/moL
③:4Al(s)+3O2(g)=2Al2O3(s); ΔH=-QlkJ/moL
4Fe(s)+3O2(g)=2Fe2O3(s); ΔH=-Q2kJ/moL
④:2H2(g)+O2(g)=2H2O(g); ΔH=-QlkJ/moL
2H2(g)+O2(g)=2H2O(l); ΔH=-Q2kJ/moL
A.①② B.③④ C.②④ D.①③
4、下列金属或氧化物可以完全溶解的是
A、1molZn与含1molHCl的稀溶液共热 B、1molCu与含4molHNO3的浓硝酸
C、1molCu与含2molH2SO4的浓硫酸共热 D、1molMnO2与含4molHCl的浓盐酸共热
3、下列叙述中正确的是
A、CO2分子内含有极性键,所以CO2分子是极性分子
B、分子晶体、原子晶体中一定含有共价键,离子晶体一定含有离子键
C、气态氢化物的稳定性:NH3>PH3>AsH3
D、某非金属元素从游离态变成化合态时,该元素一定被还原
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com