
题目列表(包括答案和解析)
1.常见的晶体有如下类型:①分子晶体 ②离子晶体 ③原子晶体 ④金属晶体,在非金属元素所形成的单质或化合物中,固态时的晶体类型可以是( )
A、①②③④ B、只有①③④ C、只有①②③ D、只有①③
21. ⑴0.75a ⑵0.14 ⑶97.5% 7.5% ⑷见下图
⑴0.75a ⑵0.14 ⑶97.5% 7.5% ⑷见下图 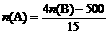
18.(10分)欲用浓硝酸法(测定反应后生成气体的量)测定某铜银合金中铜的质量分数,但资料表明:①反应中除生成NO2气体外还会有少量的NO生成;②常温下NO2和N2O4混合存在,在低于0℃时几乎只有无色的N2O4液体或晶体存在。为完成测定并验证确有NO生成,有人设计如下实验装置。
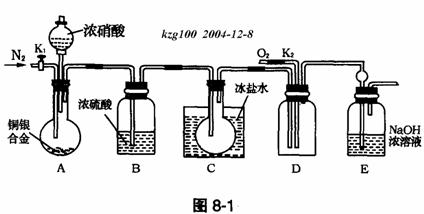
(1)实验开始前要先打开A部分的活塞K1,持续通一段时间的氮气再关闭K1,这样做的目的是__________________________。
(2)装置B瓶的作用是___________________________。
(3)A中的反应停止后,打开D中的活塞K2,并通入氧气,若反应确有NO产生,则D中应出现的现象是______________________;实验发现,通入氧气温度的高低对实验现象有较大影响,则为便于观察应通入___________________(填“冷”或“热”)的氧气。
(4)为减小测量误差,在A中反应完成和D中出现现象后,还应继续进行的操作是____
。
(5)实验测得下列数据:所用铜银合金质量:15.0g、浓硝酸:40mL13.5mol/L;实验后A中溶液体积:40mL、H+浓度1.0mol/L。若设反应中硝酸既无挥发也无分解,则:
①参加反应的硝酸的物质的量为_____________________;
②若已测出反应后E装置的生成物中含氮元素的质量,则为确定合金中铜的质量分数还需要测定的数据是_______________________。
(6)若实验只测定Cu的质量分数,不验证NO的产生,则在铜银合金与浓硝酸反应后,只需简单的实验操作就可以达到目的,请简述实验过程_________________
。
[解释]根据本题实验目的,实验必须注意以下几点:①排尽装置中的空气;②防止NO2与水反应生成NO;③实现实验中产生的NO2与NO气体分离,最后还应注意尾气吸收。
[答案]
(1)排尽装置中的空气(1分)
(2)干燥吸收水蒸气,防止NO2与水反应生成NO(1分)
(3)出现红棕色气体,(1分)热(1分)
(4)通入一定量N2使装置中残留的NO2全部转化为液态N2O4;NO 全部转化为NO2,最后被NaOH溶液吸收。(2分)
(5)①0.5mol (2分) ②C装置中烧瓶增重质量(1分)
(6)加入足量盐酸,过滤称量沉淀质量,就可求得Cu的质量。(1分)
三。本题包括三小题,共分
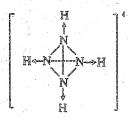
19 (10分)科学家从化肥厂生产的(NH4)2SO4中检出组成N4H4(SO4)2的物质,经测定,该物质易溶于水,在水中以SO42-和N4H44+两种离子形式存在,植物的根系极易吸收N4H44+,但它遇到碱时,会生成一种形似白磷的N4分子,N4分子不能被植物吸收。 请回答下列问题: (1)N4和N2的关系正确的是___________(填序号);
A.同种单质 B.同位素 C.同分异构体 D.同素异形体
(2)N4H4(SO4)2__________(填“能”或“不能”)和草木灰混合施用;
(3)已知白磷、NH+4、N4H4+4的空间构型均为四面体,NH+4的结构式为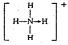 (→表示共用电子对由N原子单方面提供),白磷(P4)的结构式为
(→表示共用电子对由N原子单方面提供),白磷(P4)的结构式为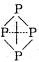 。
。
请画出N4H4+4的结构式_____________________________。
(4)已知液氨中存在着平衡2NH3 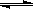 NH4++NH2-。科学家在液氨中加入氢氧化铯(CsOH)和特殊的吸水剂,使液氨中的NH4+生成N4分子,请写出液氨与氢氧化铯反应的化学方程式:_____________________________________________________。
NH4++NH2-。科学家在液氨中加入氢氧化铯(CsOH)和特殊的吸水剂,使液氨中的NH4+生成N4分子,请写出液氨与氢氧化铯反应的化学方程式:_____________________________________________________。
(5)NH3·H2O的电离方程式为NH3·H2O NH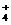 +OH-,试判断NH3溶于水后,形成的NH3·H2O的合理结构是
。(填a或b)
+OH-,试判断NH3溶于水后,形成的NH3·H2O的合理结构是
。(填a或b)
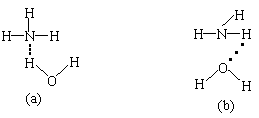
[答案](每空2分)(1)D (2)不能
(3) (4)8NH3+4CsOH=N4+4CsNH2+6H2↑+4H2O
(4)8NH3+4CsOH=N4+4CsNH2+6H2↑+4H2O
 (5 ) a
(5 ) a
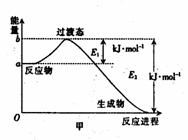
20(8分)(1)20世纪30年代,Eyring和Pelzer在碰撞理论的基础上提出化学反应的过渡态理论:化学反应并不是通过简单的碰撞就能完成,而是在反应物到生成物的过程中经过一个高能量的过渡态。图甲 是白磷(P4)和O2反应生成P4O10过程中能量变化示意图,请写出白磷(P4)和O2反应生成P4O10的热化学方程式:_________________
_____________(△H用含E1和E2的代数式表示,其中E1、E2均大于0)。
(2)白磷(图乙)是正四面体构型的分子,当与氧气作用形成P4O6时,相当于每两个磷原子之间插入一个氧原子(如图丙)。当形成P4O10时,相当于在P4O6的分子中每个磷原子又以双键结合一个氧原子(如图丁)。
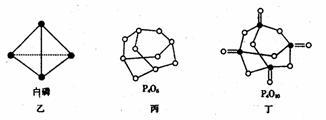
请在图丙的示意图中把磷原子用钢笔或铅笔把磷原子涂黑。
(3)进一步研究表明,化学反应的能量变化(△H)与反应物和生成物的键能有关。键能可以简单的理解为断开1mol化学键时所需吸收的能量。下表是部分化学键的键能数据:
|
化学键 |
P-P |
P-O |
O=O |
P=O |
|
键能/kJ·mol-1 |
198 |
360 |
498 |
X |
已知白磷(P4)的燃烧热为2982 kJ·mol-1,白磷完全燃烧的产物结构如图丁所示,则上表中x=________________
(4)写出1molP4与O2反应生成固态P4O6的反应热△H=_____________。
20[答案].(1)P4(s) + 5O2(g) === P4O10(s); △h=-(E2-E1)kJ·mol-1(2分)
(3)585(2分)
(4)发638kJ·mol-1(2分)
21(8分)下图是部分短周期元素的单质及其化合物的转化关系图(有关反应的条件及生成的H2O已略去),已知:(a)A、B、C、D是非金属单质,其中B、C、D在常温常压下是气体。(b)反应①、②是化工生产中的重要反应。(c)化合物E是形成酸雨的污染物之一,化合物K是常用的氮肥。(d)化合物L具有漂白性,可由Cl2与NaOH溶液反应而制得。(e)化合物J由两种元素组成,其相对分子质量为32。
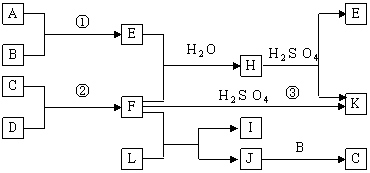
请按要求填空:
(1)反应③的化学方程式 。
(2)C的结构式 ;H的化学式 。
(3)L的溶液与化合物E反应的离子方程式 。
(4)化合物J的化学式 。
[答案](1)2NH3+H2SO4=(NH4)2SO4 (2分)
(2)N≡N (1分) (NH4)2SO3或NH4HSO3 (1分)
(3)ClO-+SO2+2OH-=Cl++SO42-+H2O(2分)
(4)N2H4(2分)
四。本题包括两小题,共18分
22(5分).将V mL NO和NO2的混合气体通过水吸收后得到a mL无色气体A,将此无色气体A与等体积氧气混合,再通过水充分吸收后,收集到5 mL无色气体B。
⑴A气体是 ,B气体是 。
⑵A气体的体积是 mL。
⑶V值的范围是 。
[答案](1) NO;O2 ⑵20mL (3)20<V <60
23(13分)已知: 4NH3十5O2 → 4NO+6H2O
4NO十3O2十2H2O→4HNO3
设空气中氧气的体积分数为0.20,氮气体积分数为0.80,请完成下列填空及计算
(1)amolNO完全转化为HNO3需要氧气_______ mol
(2)为使NH3恰好完全氧化为一氧化氮,氨-空气混合物中氨的体积分数为________(保留2位小数)。
(3)20.0moL的NH3用空气氧化,产生混合物的组成为:NO18.0mol、O212.0 mol、N2150.0 mol和一定量的硝酸,以及其它成分。(高温下NO和O2不反应)
计算氨转化为NO和HNO3的转化率。
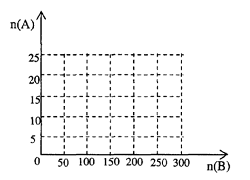
(4) 20.0moL 的NH3和一定量空气充分反应后,再转化为HNO3
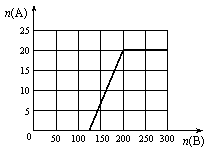
①在下图中画出HNO3的物质的量n(A)和空气的物质的量n(B)关系的理论曲线。
②写出当125≤n(B) ≤ 200时,n(A)和n(B)的关系式_________________________________。
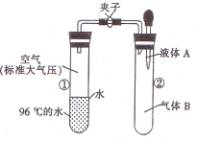
16。11.9g锡与100mL12mol·L-1HNO3共热一段时间。完全反应后测定溶液中c(H+)为
8mol·L-1,溶液体积仍为100mL。放出的气体在标准状况下体积约为8.96L。由此推断氧化产物可是 ( )
A.SnO2·4H2O B.Sn(NO3)4 C.Sn(NO3)2 D.Sn(NO3)2和Sn(NO3)4
[解析]由氮元素守衡可知后来溶液中的氮与气体中的氮之和,恰好和原来100mL12mol·L-1HNO3中的氮相等,可见锡元素未与氮结合。[答案]A
二。本题包括两小题,共16分
17(6分). 在常温常压下,注射器甲中装有N02气体,注射器乙中 装有相同体积的空气(如图所示,夹持仪器均已略去)
(1)常温下,打开两个止水夹后,同时向外拉动两注射器的活塞,且拉动的距离相同,将会 看到U形管中液面 a. (填升高下降或不变)。试解释这一现象: 。
看到U形管中液面 a. (填升高下降或不变)。试解释这一现象: 。
(2)如将注射器甲中的气体换成NH3、U形管中的CCl4换成水,仍在常温下,打开两个止水夹后,同时向里推动两注射器的活塞,且推动的距离相同,将会看到U形管中液面a (填升高、下降或不变)。试解释这一现象
[答案](1)下降;(1分)向外拉活塞时,平衡2NO2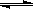 N2O4向左移动,使甲中气体压强大于乙中气体压强 (2分)
N2O4向左移动,使甲中气体压强大于乙中气体压强 (2分)
(2)升高;(1分)NH3几乎全部溶于水,使甲中气体压强小于乙中气体压强(2分)
15.往含有Ca(OH)23.7g的石灰水中滴入150mL0.5mol·L-1的H3PO4,待反应物全部作用后,下列叙述正确的是( )
A.只生成CaHPO4 B.有Ca3(PO4)2和Ca(H2PO4)2生成
C.有Ca3(PO4)2和CaHPO4生成 D.有CaHPO4和Ca(H2PO4)2 生成
[解析]本题可由Ca与P的比来快速解答:若Ca与P的比 大于或等于3:2,产物为Ca3(PO4)2 ,若Ca与P的比 介于3:2与1:1之间,产物为Ca3(PO4)2和CaHPO4 ,若Ca与P的比为1:1,产物为CaHPO4,若Ca与P的比 介于1:2与1:1之间,产物为CaHPO4和Ca(H2PO4)2 ;若Ca与P的比小于或等于1:2,产物为Ca(H2PO4)2。现在Ca与P的比为3.7/74:0.075=2:3,故产物为CaHPO4和Ca(H2PO4)2 。[答案]D
14。如图所示,夹子开始处于关闭状态,将液体A滴人试管②与气体B充分反应,打开夹子,可发现试管①内的水立刻沸腾了。则液体A和气体B的组合不可能是下列的
A.氢氧化钠溶液、二氧化碳
B.水、氨气
C.氢氧化钠溶液、一氧化氮
D.水、二氧化氮
[解析]要使试管①内的水立刻沸腾,则中气体压强要显著下降,即气体B要被液体A大量消耗。[答案]C
13、在一定温度和压强下,将一支容积为15mL的试管充满NO2后,倒置于一个盛水的水槽中,当试管内液面上升至一定高度不再变化时,在相同的条件下再通入O2,若要使试管内的液面仍处在原高度,则通入的O2体积为
A 3.75mL B 7.5mL C 8.75mL D 10.5mL
[解析]要使试管内的液面仍处在原高度,即通入的O2体积应过量 15mL,即通入的O2体积为与NO2反应的O2和过量的O2。[答案] C
12.分别配制H3PO4、KOH的乙醇溶液,取10 mL磷酸溶液在不断振荡下,滴加KOH溶液立即产生白色沉淀,并不断增多,继而又逐渐减少至消失,然后又逐渐增多到一定量不再消失,以上事实说明
A.KH2PO4、K2HPO4不溶于无水乙醇 B.KH2PO4、K3PO4不溶于无水乙醇
C.KH2PO4、K2HPO4不溶于无水乙醇 D.KH2PO4、K3PO4 和K2HPO4都溶于无水乙醇
[解析]在 磷酸溶液逐滴滴加KOH溶液时,生成物依次为:KH2PO4、K2HPO4 和 K3PO4,再由滴加过程中的现象,不难确定各物质的溶解性。[答案]B
11.将a mL NO、b mL NO2、 x mL O2的气体混合于同一试管里,将试管倒插入水中,充分反应后试管内气体全部消失,则x对a、b的函数关系式x=f(a,b)是( )
A.(a+b)/2 B.(2a+b)/3 C.(3a+b)/4 D.(4a+b)/5
[解析]由电子得失守衡可知;3a+b==4x.[答案]C
10、下列说法中不正确的是 ( )
A、NO中有少量的NO2:用水洗涤后再干燥
B、白磷应保存在水中,切割白磷应在水下进行。
C、N2中有少量的O2:通过灼热的铜网
D、红磷中有少量的白磷:加热到40℃,使白磷自燃
[解析]加热到40℃, 白磷自燃放热也会使红磷燃烧,故D错。[答案]D
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com