
题目列表(包括答案和解析)
3.向一种溶液中滴加另一种溶液后,溶液的颜色有明显变化的是
A.溴水中滴加亚硫酸钠溶液 B.稀醋酸溶液中滴加酚酞指示剂
C.硫酸铜溶液中滴加硝酸钡溶液 D.硫酸亚铁溶液中滴加硫氰化钾溶液
2.科学家通过该放射性元素的衰变的产物确定了迄今已合成的最重元素(用M表示)的存在,总共只检出一个原子。该原子经过6次衰变,每次衰变都放出一个α粒子(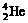 ),最后得到比较稳定的第100号元素镄的含153个中子的同位素。该最重的原子是
),最后得到比较稳定的第100号元素镄的含153个中子的同位素。该最重的原子是
A.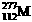 B.
B.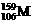 C.
C. D.
D.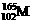
1.《科学》评出2004年10大科技突破,其中“火星上‘找’到水的影子”名列第一。下列关于水的说法中错误的是
A.用膜分离的方法可以使海水淡化
B.高效催化剂可使水分解,同时释放能量
C.密度小于1g/cm3的溶液,浓度越大,密度越小
D.金属的电化腐蚀中,水参与了正极反应
20.(1) H2O(1分);在H2O分子之间存在着氢键的作用(1分)
(2) Na2SO3 + NaClO = Na2SO4 + NaCl(2分)
(3)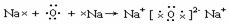 (2分)
(2分)
(4) H2(g) + Cl2(g) = 2HCl(g) ; ΔH= -184.6KJ·mol-1(2分)
21(1)每个1分共5分
|
___乙__同学正确 |
选用试剂 |
实验现象 |
|
第一种方法 |
C |
有机层无色 |
|
第二种方法 |
D |
溶液变红 |
(2)不可以,因为Br2和Fe3+都能把I氧化成I2(2分)
Fe2+;(1分) 2 Fe2++4Br-+3C12====2Fe3++2Br2+6Cl- (2分)
22⑴①该晶体是分子晶体,各分子间存在较弱的分子间作用力,故“可燃冰”熔沸点较低
②890.3 kJ·mol-1
⑵①O2+4e=2 O2– 向负极移动 ②固体碳(或炭粒)
24.(8分)硫酸工业生产应考虑综合经济效益。
(1)工业生产硫酸的原料气成分(体积分数)为:SO2 7%,O2 11%,N2 82%。
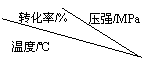 压强及温度对SO2转化率的影响如下:
压强及温度对SO2转化率的影响如下:
|
|
0.1 |
0.5 |
1 |
10 |
|
400 |
99.2 |
99.6 |
99.7 |
99.9 |
|
500 |
93.5 |
96.9 |
97.8 |
99.3 |
|
600 |
73.7 |
85.8 |
89.5 |
96.4 |
工业上,二氧化硫催化氧化过程采用的是常压而不是高压,主要原因是
____________________________________________________________________。
分析上表数据可知,二氧化硫的催化氧化是放热反应,理由是____________________________________________________________________。
(2)据测算,接触法制硫酸过程中,每生产1 t 98%的硫酸需消耗3.60×105 kJ能量。
若反应:2SO2(g)+O2(g) 2SO3(g),ΔH=-196.6 kJ /mol放出的热量完全被利用,则每生产1 t 98%的硫酸可为外界提供_____________kJ能量(不考虑其他过程释放的能量)。
(3)依据题给数据计算:在500℃0.1MPa条件下,二氧化硫的催化氧化达到平衡时,各种气体的体积比V(SO2)∶V(SO3)∶V(O2)∶V(N2)= ∶ ∶ ∶82
(结果保留两位有效数字)。
19(1)5 6 8
(2)AEF AB AF(或AE) 防倒吸
(3)实验一:将带火星的木条伸入装有过氧化氢溶液的试管中
实验二:加入Al2O3,能加快过氧化氢溶液的分解速率
(5)Al2O3在反应前后质量是否改变 干燥
(6)Al2O3的化学性质在反应前后是否改变
23.(12分)A-N均为中学化学中的常见物质,其中A是日常生活中不可缺少的物质,也是化工生产上的重要原料,单质M是目前使用量最大的金属,常温下B、E、F为气体,G为无色液体,这些物质在一定条件下存在如下转化关系,其中有些反应物或生成物已经略去。
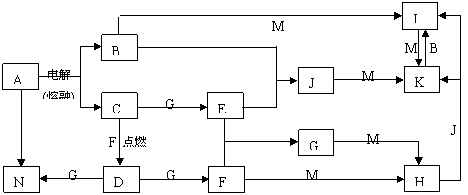
回答下列问题:
⑴H的化学式为__________,D的电子式为__________。
⑵工业上用A制取N的化学反应方程式为____________________________________。
⑶D与G反应的离子方程式为_______________________________________。
⑷I的浓溶液滴入沸水中反应的离子方程式为___________________________________。
⑸G与M反应的化学方程式为 。在一定条件下该反应也可以向相反的方向进行,请判断该反应与上述转化是否矛盾并说明理由________________________________________________________________________
22.(12分)化学在能源开发与利用中起着十分关键的作用。
⑴蕴藏在海底的“可燃冰”是高压下形成的外观像冰的甲烷水合物固体,我国南海海底有极其丰富的“可燃冰”资源。
①将“可燃冰”从海底取出,“可燃冰”将融化并放出甲烷气体。请你所学的物质结构知识加以解释: 。
②取356g分子式为CH4·9H2O的“可燃冰”,将其释放的甲烷完全燃烧生成液态水,可放出1780.6kJ的热量,则甲烷的燃烧热为 。
⑵设计出燃料电池使液化石油气氧化直接产生电流是新世纪最富有挑战性的课题之一。最近有人制造了一种燃料电池,一个电极通入空气,另一电极通入液化石油气(以C4H10表示)电池的电解质是掺杂了Y2O3的ZrO2晶体,它在高温下能传导O2-离子。
①已知该电池的负极反应为C4H10+13O2――26e―=4CO2+5H2O,则该电池的正极反应式为 ,电池工作时,固体电解质里的O2-向 极移动。
②液化石油气燃料电池最大的障碍是氧化反应不完全而产生的 (填写物质的名称)堵塞电极的气体通道。
21.在足量的稀氯化亚铁溶液中,加入1-2滴液溴,振荡后溶液变为黄色。甲同学认为这不是发生化学反应所致,使溶液变黄色的物质是Br2;乙同学认为这是发生化学反应所致,使溶液变黄色的物质是Fe3+
(1)现提供以下试剂:
A.酸性高锰酸钾溶液 B.氢氧化钠溶液 C.四氯化碳 D.硫氰化钾溶液
请你判断哪位同学的推断是正确的,并用两种方法加以验证,写出选用的试剂编号及实验中观察到的现象:
|
________同学正确 |
选用试剂 |
实验现象 |
|
第一种方法 |
|
|
|
第二种方法 |
|
|
(2)若选用淀粉碘化钾溶液来判断哪位同学的推断是正确的,你认为是否可行?____
理由是:____________________________________________________________
根据上述实验推测,若在稀溴化亚铁溶液中通入氯气,首先被氧化的离子是__________
写出在稀溴化亚铁溶液中通入足量氯气时的离子方程式:__________________________
20.(8分)有A、 B 、C 、D 、E五种短周期元素,它们的原子序数依次增大。已知:A和C、B和D 分别位于同主族,且B、D 质子数之和是A、C质子数之和的2倍,E在同周期元素中原子半径最小。
⑴A2B和A2D两者的沸点较高的是___________(填化学式),其原因是__________________.
⑵由B 、C、 D 、E 四种元素中的若干种形成的盐中,有两种盐(组成元素可不完全相同)溶液都呈碱性,但它们等物质的量混合后溶于水所得溶液呈中性,这两种盐在溶液中相互反应的化学方程式为_____________________________________.
⑶用电子式表示B、 C 两元素形成化合物C2B的过程_________________________________.
⑷已知1 g A 单质在E 单质中完全燃烧时放的92.3 KJ热量,写出该反应的热化学方程式_______________________________________
19.(10分)(1)下列实验操作或对实验事实的描述不正确的是____________________(填序号,错选一个倒扣2分,不出现负分)
① 用量筒量得稀硫酸溶液8.0mL;② 浓硫酸不小心沾在皮肤上,应立即用大量的水冲洗;③用热的浓HCl洗涤附着有MnO2的试管;④在硫酸铜晶体结晶水含量的测定中,若加热后的无水硫酸铜粉末表面发黑,则所测结晶水含量可能会偏高 ;⑤ Fe(OH)3胶体与FeCl3溶液可用过滤的方法分离;⑥用碱式滴定管量得KMnO4溶液20.50mL ;⑦ 实验室快速制备少量H2、O2、NH3、HCl可以用同一种气体发生装置;⑧ 配制一定浓度的溶液时,若定容时不小心加水超过容量瓶的刻度线,应立即用滴管吸去多余的部分。
(2)有常用玻璃仪器组成的下列六种实验装置(根据需要可在其中加入液体或固体)
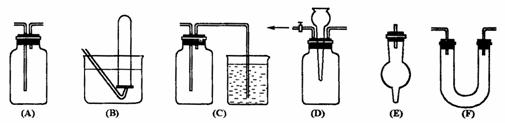
①能用做干燥二氧化硫气体的装置有 ;(填代号,下同)
②既能用于收集氯气又能用于收集一氧化氮气体的装置有 ;
③在氯气和铁反应实验中,能添加在制气和化合反应装置之间以除去氯气中氯化氢等杂质气体的装置有 ;
④若用C装置做二氧化硫与烧杯中氢氧化钠溶液反应实验,则其中广口瓶的作用是 。
(3)学校化学兴趣小组知道二氧化锰能作过氧化氢分解的催化剂后,想再探究其他一些物质如氧化铝是否也可以作过氧化氢分解的催化剂。请你一起参与他们的探究过程。
①[问题]:Al2O3能不能作过氧化氢分解的催化剂呢? ②[猜想]:Al2O3能作过氧化氢分解的催化剂。
③[实验验证]:
|
|
实验步骤 |
实验现象 |
实验结论 |
|
实验一 |
|
木条不复燃 |
常温下过氧化氢溶液不分解 |
|
实验二 |
在装有过氧化氢溶液的试管中加入少量Al2O3,然后将带火星的木条伸入试管中 |
木条复燃 |
|
④[结论]:Al2O3能加快过氧化氢分解速率,故Al2O3能作过氧化氢分解的催化剂。
⑤[讨论与反思]:经过讨论,有的同学认为只有上述两个证据,不能证明Al2O3能作过氧化氢的催化剂,还要补充一个探究实验:
实验三:[实验目的]:探究 。
[实验步骤]:①准确称量Al2O3(少量)的质量;②完成实验二;③待反应结束后,将实验二试管里的物质进行过滤、洗涤、 、称量;④对比反应前后Al2O3的质量。
[讨论]:如果Al2O3在反应前后质量不变,则说明Al2O3可以作过氧化氢分解的催化剂。
⑥但小华认为,要证明猜想,上述三个实验还不足够,还需要再增加一个探究实验:探究
。
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com