
题目列表(包括答案和解析)
25(8分)下图是200 mg MnC2O4·2H2O晶体放在坩埚里加热分解时,所得固体产物的质量(m)随温度(t)变化的关系曲线。(已知草酸锰不稳定,但其中锰元素的化合价在300oC以下不变)
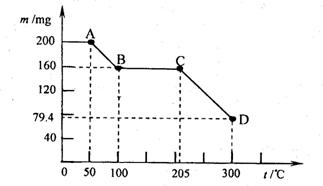
试回答下列问题:
(1)写出B点固体产物的化学式 ;
(2)从B点到C点过程中固体物质质量不变的原因是 。
(3)通过计算确定D点处产物的相对分子质量,并推断其合理的化学式。
26(11分)取一定质量的Fe 、Cu 混合物的粉末平均分成四等份,分别加入不同体积但同浓度的稀硝酸,实验中收集到的NO气体的体积及剩余固体的质量均记录在下表中(气体体积均在标准状况下测定)。
|
实验序号 |
① |
② |
③ |
④ |
|
稀硝酸体积 |
100mL |
200mL |
|
400mL |
|
剩余固体质量 |
17.2g |
8.00g |
固体恰好 全部溶解 |
0 |
|
气体体积 |
2.24L |
4.48L |
|
|
求:(1)计算稀硝酸的物质的量浓度;
24.(12分)化学在能源开发与利用中起着十分关键的作用。
⑴蕴藏在海底的“可燃冰”是高压下形成的外观像冰的甲烷水合物固体,我国南海海底有极其丰富的“可燃冰”资源。
①将“可燃冰”从海底取出,“可燃冰”将融化并放出甲烷气体。请你所学的物质结构知识加以解释: 。
②取356g分子式为CH4·9H2O的“可燃冰”,将其释放的甲烷完全燃烧生成液态水,可放出1780.6kJ的热量,则甲烷的燃烧热为 。
⑵设计出燃料电池使液化石油气氧化直接产生电流是新世纪最富有挑战性的课题之一。最近有人制造了一种燃料电池,一个电极通入空气,另一电极通入液化石油气(以C4H10表示)电池的电解质是掺杂了Y2O3的ZrO2晶体,它在高温下能传导O2-离子。
①已知该电池的负极反应为C4H10+13O2――26e―=4CO2+5H2O,则该电池的正极反应式为 ,电池工作时,固体电解质里的O2-向 极移动。
②液化石油气燃料电池最大的障碍是氧化反应不完全而产生的 (填写物质的名称)堵塞电极的气体通道。
23.(8分)下表是三个不同短周期部分元素的原子半径及主要化合价:
|
元素代号 |
W |
R |
X |
Y |
Z |
|
原子半径/nm |
0.037 |
0.157 |
0.066 |
0.070 |
0.077 |
|
主要化合价 |
+1 |
+1 |
-2 |
-3,+5 |
+2、+4 |
试回答下列问题:
⑴五种元素中原子半径最大的元素在周期表中位于 。
⑵写出下列有关反应的化学方程式:
①Z的单质与Y元素的最高价氧化物对应的水化物反应:
;
②R2X2与ZX2反应:
。
⑶X可与Z形成一种有恶臭味的气体,该气体与氧气发生反应的物质的量之比为1:2,且反应前后气体的总体积不变,试写出该气体分子(分子中各原子最外层均满足8e-结构,且含有非极性键)的电子式 。
22.(8分)如图所示:
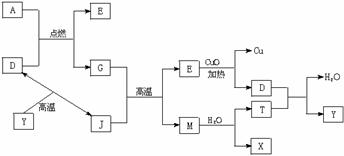
其中A、G是固体单质,其余是化合物。X是常用于切割和焊接金属的可燃性气体;Y是一种难溶于水的白色固体,它的式量是100。
请填空:
(1)D的电子式是 。
(2)A跟D反应的化学方程式是 ;该反应的反应热ΔH 0(填“<、=、>”)。
(3)在高温条件下,G跟J反应的化学方程式是 。
21.(12分)A-N均为中学化学中的常见物质,其中A是日常生活中不可缺少的物质,也是化工生产上的重要原料,单质M是目前使用量最大的金属,常温下B、E、F为气体,G为无色液体,这些物质在一定条件下存在如下转化关系,其中有些反应物或生成物已经略去。
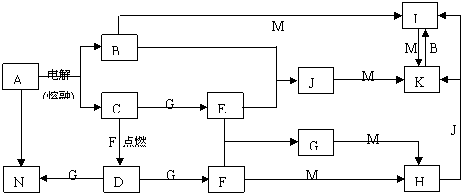
回答下列问题:
⑴H的化学式为__________,D的电子式为__________。
⑵工业上用A制取N的化学反应方程式为____________________________________。
⑶D与G反应的离子方程式为_______________________________________。
⑷I的浓溶液滴入沸水中反应的离子方程式为___________________________________。
⑸G与M反应的化学方程式为 。在一定条件下该反应也可以向相反的方向进行,请判断该反应与上述转化是否矛盾并说明理由________________________________________________________________________
__________________________________________________。
20.(12分)某学生拟通过测定粗锌(杂质与稀硫酸不反应)与稀硫酸反应产生的气体体积,来测定粗锌中锌的纯度。现有粗锌、稀硫酸、试管、镊子、单孔橡皮塞、导气管、托盘天平、量筒、水槽、铁架台(附铁夹)等仪器、药品。
⑴实验时除需测定粗锌的质量、氢气的体积之外,是否还需要其他物理量?如需要,请指出___________________________,否则,此空不填。
⑵实验时在检查装置气密性后,如何将试剂加入试管并使反应开始?______________
_______________________________________________________________________________________________________________________________________________。
⑶以下是测量收集到气体体积必须包括的几个步骤:①调整量筒内外液面高度使之相同;②使试管和量筒内的气体都冷却至室温;③读取量筒内气体的体积。这三步操作的正确顺序是:________________________(请填写步骤代号)。
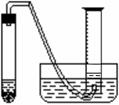 ⑷测量收集到气体体积(图中夹持仪器已省略)时,如何使量筒内外液面的高度相同?_____________________________。
⑷测量收集到气体体积(图中夹持仪器已省略)时,如何使量筒内外液面的高度相同?_____________________________。
⑸如果实验中测得粗锌质量为a g,得到的氢气体积是b L(已折算成标准状况),水蒸气的影响忽略不计,粗锌中锌的质量分数的计算式为(含a、b,不必化简):___________________。
⑹试根据上述仪器,提出更简捷的实验方案:__________________________________
_______________________________________________________________________。
19.(15分)(1)指出在使用下列仪器(已净)或用品的第一步操作:
|
石蕊试纸检验气体 |
容量瓶 |
集气瓶收集氯化氢 |
|
|
|
|
(2)下面是中学化学实验常见的几种定量仪器:A.量筒 B.容量 C.滴定管 D.托盘天平 E.温度计 F.球形移液管,其中
|
标出仪器使用温度的是 |
标有0刻度,且0刻度在上方的是 |
能够用以精确量取液体体积的是 |
使用A、C时由于俯视读数,使得到的数据比正确数据偏小的是 |
|
|
|
|
|
(3)配制一定物质的量浓度为0.2mol/LNaOH溶液500mL,填空并请回答下列问题:
|
应称量NaOH的质量 |
应选用容量瓶的规格 |
除容量瓶外还需要的其它仪器 |
|
g |
m |
|
用托盘天平称取固体样品时(1g 以下使用游码),若将样品放在了天平的右盘,读数为10.5g,则所称样品的实际质量为 g。
下列操作对配制的NaOH溶液浓度有偏高影响的是 。
A.称量时将NaOH固体直接放在天平托盘上面的纸上
B.将称量的NaOH固体置露在空气的时间过长
C.选用的容量瓶内有少量的蒸馏水
D.在烧杯中溶解NaOH后,立即将所得溶液注入容量瓶中
E.整个配制过程中容量瓶不振荡
16.在一定温度下,将等量的气体分别通入起始体积相同的密闭容器Ⅰ和Ⅱ中,使其发生反应,t0时容器Ⅰ中达到化学平衡,X、Y、Z的物质的量的变化如图所示。则下列有关推断正确的是
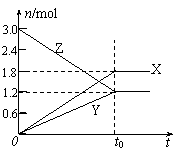

 A.该反应的化学方程式为:3X+2Y 2Z
A.该反应的化学方程式为:3X+2Y 2Z
B.若两容器中均达到平衡时,两容器的体积V(Ⅰ)<V(Ⅱ),则容器Ⅱ达到平衡所需时间大于t0
C.若两容器中均达到平衡时,两容器中Z的物质的量分数相同,则Y为固态或液态
D.若达平衡后,对容器Ⅱ升高温度时其体积增大,说明Z发生的反应为吸热反应
请将选择题答案填入以下空格内
第Ⅱ卷(非选择题 共86分)
15.室温下,下列混合溶液中,各离子浓度的关系正确的是
A.pH=12的氨水溶液与pH=2的盐酸溶液等体积混合
c(NH4+)>c(Cl-)>c(OH-)>c(H+)
B.浓度均为0.1mol·L-1的硫酸氢铵溶液与氢氧化钠溶液等体积混合
c(Na+)>c(SO42-)>c(NH4+)>c(H+)>c(OH-)
C.浓度均为0.1mol·L-1的小苏打溶液与烧碱溶液等体积混合
c(Na+)+c(H+)=2c(CO32-)+c(OH-)
D.浓度均为0.1mol·L-1的醋酸溶液与氢氧化钠溶液等体积混合
c(Na+)=c(CH3COO-)>c(OH-)=c(H+)
14.气态中性原子失去一个电子转化为气态正离子所需要的最低能量叫做第一电离能(I1),气态正离子继续失去电子所需最低能量依次称为第二电离能(I2)、第三电离能(I3)……下表是第三周期部分元素的电离能[单位:eV(电子伏特)]数据。
|
元素 |
I1/eV |
I2/eV |
I3/eV |
|
甲 |
5.7 |
47.4 |
71.8 |
|
乙 |
7.7 |
15.1 |
80.3 |
|
丙 |
13.0 |
23.9 |
40.0 |
|
丁 |
15.7 |
27.6 |
40.7 |
下列说法正确的是
A.甲的金属性比乙强 B.乙的化合价为+1价
C.丙可能为非金属元素 D.丁一定是金属元素
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com