
题目列表(包括答案和解析)
3.“过渡态”方法. 思路:相同倍数增加各种反应物的浓度,相当于增大体系压强,根据平衡移动方向来确定转化率的变化情况. 例9. .一真空密闭容器中盛有1molPCl5,加热到200℃时发生反应.PCl5(g) PCl3(g)+Cl2(g),反应达到平衡时,PCl5所占体积百分数为M%.若在同一温度和同一容器中,最初投入的是2molPCl5 ,反应达平衡时,PCl5所占体积百分数为N%,则M和N的正确关系是[ ] A.M>N B.M <N C.M=N D.无法比较 解析:从1molPCl5 到2molPCl5投料,相当于增大体系压强,对该可逆反应而言,促使平衡逆移,反应达平衡时,PCl5所占体积百分数增大,故选________
巩固练习
 (一)选择题
(一)选择题
|
 (一)化学平衡的图象问题研究
1. 作用:化学反应速率和化学平衡的有关理论具有一定的抽象性,.运用各种图象能直观地反映可逆反应的变化规律及特点,.能从定性和定量两方面来分析和研究变化的因素、方向和程度.
2.方法:
(1)注重纵坐标和横坐标所对应的物理量.,只要其中一个物理量改变,就可能导致图象的改变.
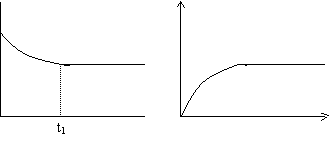
例如 对一可逆反应从起始到达平衡,某反应物的A的百分含量)、A的转化率aA分别对时间作图,曲线正好相反.
(一)化学平衡的图象问题研究
1. 作用:化学反应速率和化学平衡的有关理论具有一定的抽象性,.运用各种图象能直观地反映可逆反应的变化规律及特点,.能从定性和定量两方面来分析和研究变化的因素、方向和程度.
2.方法:
(1)注重纵坐标和横坐标所对应的物理量.,只要其中一个物理量改变,就可能导致图象的改变.
例如 对一可逆反应从起始到达平衡,某反应物的A的百分含量)、A的转化率aA分别对时间作图,曲线正好相反.

|
t1 t
A的百分含量与时间关系 A的转化率与时间关系
(2)弄清纵坐标和横坐标两种物理量之间的相互关系。.作图或析图时要注意变化的方向、趋势、程度,.如考虑是直线还是曲线?是上升还是下降?到一定时是否会不再改变?若是两条或两条以上的直线,斜率是否相同?若是两曲线,它们的曲率是否相等?……这一系列的问题必须思考清楚。. (3)抓住关键的点:如原点、最高点、最低点、转折点(拐点)、交点等.。同样有一系列问题值得去好好思考,如该不该通过原点?有没有最高(或最低)点?为何有转折点、交点等?
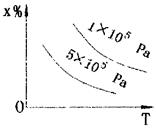
3.图象类型 (1)横坐标--时间(t) 纵坐标--反应速率(v) 或某物质浓度(C)或某成分的百分含量(A%) 或某反应物的转化率(aA) 特点: ①可逆反应从非平衡到达平衡以前,v、C、A% 、aA均随时间(t)变化,到达平衡后,则不随时间而改变.。图象中一定将出现平行于横坐标的直线,简称“平台”. ②出现转折“平台”的先后取决于达到平衡所需要的时间.而时间的长短又取决于反应速率的大小. 温度(T)一定,压强(P)越大,V正、V逆越大,t越小 压强(P)一定,温度(T)越大,V正、V逆越大,t越小 T、P一定,使用正催化剂后V正、V逆均增大,t缩小. ③“平台”的相对高低,则由外界条件对平衡的影响来决定.“平台”越高,说明条件越有利于纵坐标对应物理量的提高.反之,则不利. 故可根据图象特点来分析可逆反应特点. 例1 已知某可逆反应mA(g)+nB(g) pC(g)+Q在密闭容器中进行反应,测得在不同时间t、温度T和压强P与反应物B在混合气中的百 分含量B%的关系曲线如图所示. A.T1<T2,P1>P2,m+n>P,Q<0 B.T1> T2,P2>P1,m+n<P,Q<0 C.T2> T1,P2>P1,m+n<P,Q<0 D.T1> T2,P2>P1,m+n>P,Q>0 解析:①根据达到平衡的时间长短,可断定 T2<T1,P2>P1 ②根据“平台”高低,可断定 低温有利于B%增大,说明逆反应是放热反应,即正反应为吸热,Q<0 高压有利.B%增大,说明增大压强,平衡逆移,故m+n<P. 由此可知,本题答案:
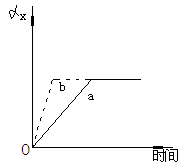
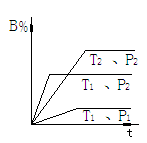
 例2 如图所示,a曲线表示一定条件下可逆反
应:X(g)+Y(g) 2Z(g)+W(s)+Q的反应过程中X
的转化率和时间的关系.若使a曲线变为b曲线,可
采取的措施是
[ ]
A.加入催化剂 B.增大Y的浓度
C.降低温度 D.增大体系压强
解析:①达平衡所需时间b<a
正逆反应速率Vb >Va
例2 如图所示,a曲线表示一定条件下可逆反
应:X(g)+Y(g) 2Z(g)+W(s)+Q的反应过程中X
的转化率和时间的关系.若使a曲线变为b曲线,可
采取的措施是
[ ]
A.加入催化剂 B.增大Y的浓度
C.降低温度 D.增大体系压强
解析:①达平衡所需时间b<a
正逆反应速率Vb >Va  ②改变条件后ax不变
平衡不移动
③该可逆反应ΔVg=0
可加催化剂或加压
答案:
②改变条件后ax不变
平衡不移动
③该可逆反应ΔVg=0
可加催化剂或加压
答案:
在反应速率(v)-时间(t)图象中,在保持平衡的某时刻t1改变某一条件前后,V正、V逆的变化有两种: V正、V逆同时突破--温度、压强、催化剂的影响 V正、V逆之一渐变--一种成分浓度的改变
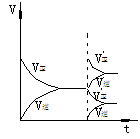 现图示如下:
图
改变条件
增加反应物浓度
现图示如下:
图
改变条件
增加反应物浓度
 降低生成物浓度
降低生成物浓度
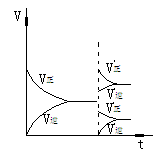
升温或加压(Δng≠0)
 |
|||
|
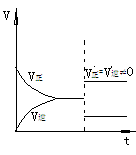 |
|||||
|
|||||
|
|||||

 (5)在浓度C-时间t图象中
改变温度瞬间,各物浓度不变,故平衡虽破坏,但各物质的浓度变化均连续.
改变压强瞬间,各物质浓度(气体)均突变.加压--突增,减压--突减.
改变某一成分浓度时,该成分浓度突变,其它物质不变,故变化是连续的.
例 3. 可逆反应N2+3H2 2NH3+Q,从反应开始经t1秒达平衡状态,因条件改变,平衡在t2秒时发生移动,在t3秒时,又达到新的平衡状态.试根据t2-t3秒曲线判断,下列图1、图2所表示的平衡移动方向和变化条件各是什么?
(5)在浓度C-时间t图象中
改变温度瞬间,各物浓度不变,故平衡虽破坏,但各物质的浓度变化均连续.
改变压强瞬间,各物质浓度(气体)均突变.加压--突增,减压--突减.
改变某一成分浓度时,该成分浓度突变,其它物质不变,故变化是连续的.
例 3. 可逆反应N2+3H2 2NH3+Q,从反应开始经t1秒达平衡状态,因条件改变,平衡在t2秒时发生移动,在t3秒时,又达到新的平衡状态.试根据t2-t3秒曲线判断,下列图1、图2所表示的平衡移动方向和变化条件各是什么?
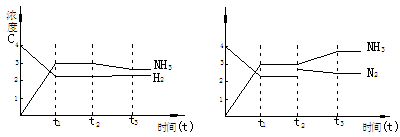
图1 图2 解析 图1中t2-t3曲线与原来连续变化,说明只可能为改变______引起.NH3浓度下降,H2浓度增大,说明平衡是逆向移动,故变化的条件是___________. 图2中 ,t2时改变条件前后NH3的浓度连续变化,而N2浓度突变,说明只能是增加__________浓度引起,平衡正向移动. 例 5.气态反应A+B C+D,其它条件不变,在有催化剂条件(a)时和无催化剂条件(b)时的反应过程中,有关的量(纵坐标)随时间(横坐标)的变化情况错误的是[ ]
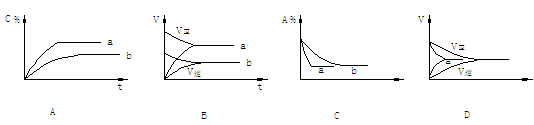
解析:使用催化剂,同等程度改变正逆反应速度,缩短达到平衡所需时间,但不改变平衡状态。故不论有无催化剂,达到平衡时同一成分的百分含量相同。所以选项A错___对。选项D中似乎达平衡所需时间长短合理,但使用催化剂,反应速率不但不增大,反而减小,显然不合理。本题正确选项:__________
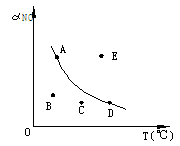
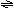 例6..2.右图为条件一定时,反应
2NO+O2 2NO2+Q(Q>0)中NO的最大转
化率与温度变化关系曲线图,图中有A、B、C、D、
E五点,其中表示未达到平衡状态,且V正<V逆的
点是[ ]
例6..2.右图为条件一定时,反应
2NO+O2 2NO2+Q(Q>0)中NO的最大转
化率与温度变化关系曲线图,图中有A、B、C、D、
E五点,其中表示未达到平衡状态,且V正<V逆的
点是[ ]
A.B和C B.A和E C.E D.A和C 解析:当条件一定时,反应的最大转化率一定是达平衡状态时。该图像与初中所学的溶解度曲线很相似。A、D所在的曲线上所有的点均为平衡时的状态。曲线上下的点均为非平衡时的状态。反应从非平衡自发达平衡。从图中可看出,B、C所在状态的转化率小于该温度平衡时。说明反应正向____方向移动。即V正>V逆。而E所在状态的转化率大于该温度平衡时的,说明反应正向逆反应方向移动。即V正<V逆。故本题选______.。
(2)横标--温度T 纵标--百分含量A% 或转化率aA 或反应速率C 特点:①横坐标为T时,纵标对应的各物理量均随T变化而变化. ②若测得在不同温度下经过足够长时间达平衡时A%、αA、C均随T单调变化.
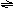 ③若测得在不同温度下经过同一时间在某一时刻测得A%、αA、C随T变化而可能呈现先上升→达最高点→ 下降的变化趋势
③若测得在不同温度下经过同一时间在某一时刻测得A%、αA、C随T变化而可能呈现先上升→达最高点→ 下降的变化趋势

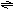 例7. 下图表示外界条件(温度、压力)的变化对下列反应的影响.
L(s)+G(g) 2R(g)-Q(吸热)
在图中Y轴是指
例7. 下图表示外界条件(温度、压力)的变化对下列反应的影响.
L(s)+G(g) 2R(g)-Q(吸热)
在图中Y轴是指
A.平衡混合气中R的质量分数 B.平衡混合气中G的体积分数 C.G的转化率 D.L的转化率
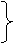
 解析 由图象可知:T↗,Y↓.
G%↓,R%↗.
由反应可知:T↗,平衡正移.
反应物α↗.
答案:_________
解析 由图象可知:T↗,Y↓.
G%↓,R%↗.
由反应可知:T↗,平衡正移.
反应物α↗.
答案:_________
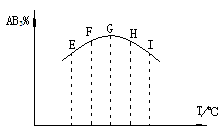 例5 在容积相同的五个密闭容器中分别放
入同量的A2和B2,在不同温度下同时任其发生
反应:A2(g)+3B2(g)
2AB3(g),分别在
某一同时刻测得其中AB3所占的体积分数变化
如图所示.下列说法不正确的是 [ ]
A.正反应是放热反应
B.E、F二点尚未达到平衡
C.H、I二点尚未达到平衡
D.G、H、I三点可能已达平衡状态
解析 随着温度的升高反应速率加快.从G到H、I,AB3%所占的体积分数降低,能得出正反应是放热反应;E、F两点AB3%比G点低,原因是低温下反应速率慢,反应未达平衡状态.选__________
例5 在容积相同的五个密闭容器中分别放
入同量的A2和B2,在不同温度下同时任其发生
反应:A2(g)+3B2(g)
2AB3(g),分别在
某一同时刻测得其中AB3所占的体积分数变化
如图所示.下列说法不正确的是 [ ]
A.正反应是放热反应
B.E、F二点尚未达到平衡
C.H、I二点尚未达到平衡
D.G、H、I三点可能已达平衡状态
解析 随着温度的升高反应速率加快.从G到H、I,AB3%所占的体积分数降低,能得出正反应是放热反应;E、F两点AB3%比G点低,原因是低温下反应速率慢,反应未达平衡状态.选__________
 (二)解决化学平衡问题的重要思维方法
1.可逆反应“不为零”原则.
可逆性是化学平衡的前提,达到平衡时应是反应物和生成物共存的状态,每种物质的量不为零.
一般可用极限分析法推断. 即假设反应不可逆,则最多生成产物多少,有无反应物剩余,余多少.这样的极值点是不可能达到的,故可用确定某些范围或在范围中选择合适的量.
例3 在一定温度下将1 molCO和1mol水蒸气放在密闭容器中反应:CO+H2O CO2+H2,达平衡后测得CO2为0.6mol,再通入4mol水蒸气,达新平衡后CO2的物质的量可能是[ ]
A.0.6mol B.1mol C.0.8mol D.1.2mol
解析 加入H2O(g)平衡正移,n·CO2>0.6mol但不可能任意增大,根据“不为零”原则,1molCO即使完全反应也只可能生成1molCO2,所以0.6mol<nCO2<1mol.答案__合适.
2.“一边倒”原则
可逆反应,在条件相同时(等温等容),若达到等同平衡,其初始状态必须能互变,从极限角度看,就是各物质的物质的量要相当.因此可以采用一边倒的原则来处理以下问题:
(二)解决化学平衡问题的重要思维方法
1.可逆反应“不为零”原则.
可逆性是化学平衡的前提,达到平衡时应是反应物和生成物共存的状态,每种物质的量不为零.
一般可用极限分析法推断. 即假设反应不可逆,则最多生成产物多少,有无反应物剩余,余多少.这样的极值点是不可能达到的,故可用确定某些范围或在范围中选择合适的量.
例3 在一定温度下将1 molCO和1mol水蒸气放在密闭容器中反应:CO+H2O CO2+H2,达平衡后测得CO2为0.6mol,再通入4mol水蒸气,达新平衡后CO2的物质的量可能是[ ]
A.0.6mol B.1mol C.0.8mol D.1.2mol
解析 加入H2O(g)平衡正移,n·CO2>0.6mol但不可能任意增大,根据“不为零”原则,1molCO即使完全反应也只可能生成1molCO2,所以0.6mol<nCO2<1mol.答案__合适.
2.“一边倒”原则
可逆反应,在条件相同时(等温等容),若达到等同平衡,其初始状态必须能互变,从极限角度看,就是各物质的物质的量要相当.因此可以采用一边倒的原则来处理以下问题:
(1)化学平衡等同条件(等温等容)
aA(g)+bB(g) cC(g)
①始 a b
0 平衡态Ⅰ
②始 0 0 c 平衡态Ⅱ
③始 x y
z 平衡态Ⅲ
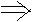
为了使平衡Ⅲ =Ⅱ=Ⅰ
根据“一边倒”原则,即可得
x+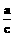 z=a
z=a
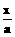 +
+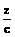 =1
y+
=1
y+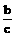 z=b
z=b
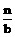 +
+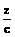 =1
=1
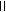
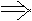
 例8 温度、催化剂不变,向某一固定体积的密闭容器内按下列各组物质的量加入H2、N2、NH3,反应达平衡时;氨气浓度最大的一组是[ ]
例8 温度、催化剂不变,向某一固定体积的密闭容器内按下列各组物质的量加入H2、N2、NH3,反应达平衡时;氨气浓度最大的一组是[ ]
|
|
A |
B |
C |
D |
|
H2 |
6 |
1 |
3.5 |
5 |
|
N2 |
2 |
0 |
1 |
1.5 |
|
NH3 |
0 |
4 |
2 |
1 |
 解析 2NH3 N2+3H2.根据反应“一边倒”换算.
B 0 2 6+1=7
C 0 2 3+3.5=6.5
D 0 2 1.5+5=6.5
由此可知,符合题意的是_____
解析 2NH3 N2+3H2.根据反应“一边倒”换算.
B 0 2 6+1=7
C 0 2 3+3.5=6.5
D 0 2 1.5+5=6.5
由此可知,符合题意的是_____
3.有关转化率的判断计算
1.化学平衡图象的特征分析 2.化学平衡问题研究的重要思维方
18.室温下,在25 mL 0.1 mol/LNaOH溶液中逐滴加入0.2 mol/L CH3COOH溶液,
曲线如下图所示,若忽略两溶液混合时的体积变化,有关粒子浓度关系比较错误的是
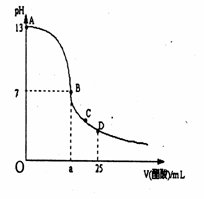 A.在A、B间任一点,溶液中一定都有
A.在A、B间任一点,溶液中一定都有
c(Na+)+ c(H+)= c(CH3COO-)+c(OH-)
B.在B点:a>12.5,且有
c(Na+)=c(CH3COO-)>c(OH-)=c(H+)
C.在C点:c(Na+)>c(CH3COO-) >c(H+)>c(OH-)
D.在D点:c(CH3COO-)+c(CH3COOH)= 0.2 mol/L
高三化学教学质量检测试题
17.新鲜水果、蔬菜、乳制品中富含的维生素C具有明显的抗衰老作用,但易被空气氧化。某课外小组利用碘滴定法测某橙汁中维生素C的含量,其化学方程式如下:
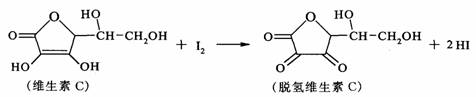
下列说法正确的是
A.上述反应为取代反应
B.维生素C在酸性条件下水解只得到1种产物
C.维生素C不可溶于水,可溶于有机溶剂
D.维生素C的分子式为C6H8O6
16.25 ℃时,pH=3的盐酸a L分别与下列3种溶液充分混合后,溶液均呈中性: ① c(NH3·H2O)
=10-3 mol·L-1的氨水b L;②c(OH-)=10-3 mol·L-1的氨水c L;③c(OH-)=10-3mol·L-1的Ba(OH)2
溶液d L,试判断a、b、c、d的数量大小关系为
A.a=b>c>d B.b>a=d>c C.b>a>d>c D.c>a=d>b
15.下面二维平面晶体所表示的化学式为AX3的是 ( )
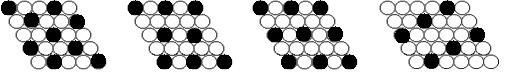
A. B. C. D.
14.科学家预言超级原子的发现将会重建周期表,2005年1月美国科学家在《Science》上发表论文,
宣布发现A1的超原子结构Al13和A114,并在质谱仪检测到稳定的Al13I-等。Al13、A114的性质很像现
行周期表中的某主族元素,已知这类超原子当具有40个价电子时最稳定。下列说法不正确的是 ( )
A.A ll4与ⅡA族元素性质相似
B.A l13超原子中A1原子间是通过离子键结合的
C.A l13在气相中与HI反应的方程式可表示为:A l 13 + HI = HAl13I
D.A113与卤素性质类似
13.下列说法中正确的是 ( )
A.在相同条件下,若将等量的硫蒸气和硫固体分别完全燃烧,后者放出热量多
B.由“C(石墨)=C(金刚石);△H=+1.9kJ·mol-1”可知,金刚石比石墨稳定
C.在稀溶液中:H+(aq)+OH-(aq)=H2O(l);△H=-57.3kJ·mol-1,若将含0.5mol H2SO4的
浓硫酸与1mol NaOH溶液混合,放出的热量大于57.31 kJ
D.在101Kpa时,2g H2完全燃烧生成液态水,放出285.8kJ热量,氢气燃烧的热化学方程式表示为:2H2(g)+O2(g)=2H2O(l);△H=+285.8kJ·mol-1
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com