
题目列表(包括答案和解析)
23、(共18分)第一种:普客行驶时间 (2分)
(2分)
8:20发车,10:16到达 (1分)
第二种:快客行驶时间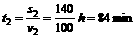 (2分)
(2分)
8:30发车,9:54到达。 (1分)
第三种:火车每段匀变速行驶时间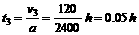 (2分)
(2分)
火车时出站变速行驶总时间t4=6t3=0.3h=18min (1分)
火车匀变速行驶路程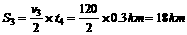 (2分)
(2分)
火车匀速行驶时间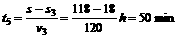 (2分)
(2分)
火车行驶总时间 t6=t1+t5+2×5min=78min (2分)
8:33发车,9:51到达。 (1分)
由此可知:应选择乘坐8:33的火车 (2分)
22、(共18分)(1)(第①题2分,其余每问各1分,共7分)
①0.901(0.900~0.902均可)×10-6 ②图略 42(±1)
F=42Δx或F=kAΔx ③B ④A
(2)(第①题每空2分;第②题5分,变阻器未用分压法扣3分,电流表A2未用内接法扣1分,无电键扣1分;共11分)①A2 V2 E2 ② 如右图所示
15、ACD 16、BC 17、CD 18、A 19、B 20、ABD 21、BC
第II卷 (非选择题 共174分)
注:解答物理计算题的方法可能有多种,只要原理正确,过程清楚,结果正确就应评满分。若部分正确,参照此标准按分段评分原则计分。
1、A 2、C 3、B 4、D 5、B 6、B 7、A 8、C 9、C 11、B 12、A 13、D 14、A
(二)画出实验用的电路图。
|
|
普客汽车 |
快客汽车 |
火车 |
|
里程/km |
116 |
140 |
118 |
|
班次 |
7:20 |
8:00 |
|
|
8:20 |
8:30 |
8:33 |
|
|
10:30 |
9:00 |
||
|
14:30 |
9:30 |
15:00 |
|
|
…… |
…… |
|
23. (18分)一位旅客可用三种方法从自贡到泸州:第一种是乘普客汽车经邓关、赵化到达。第二种是乘快客汽车经内江、隆昌的高速公路到达。第三种是乘火车到达。右面是三种车的发车时刻及里程表。已知普客汽车全程平均速度大小为60km/h,快客汽车全程平均速度大小为100km/h,两车途中均不停站,火车在中途需停靠内江站和隆昌站各5min,设火车进站和出站都做匀变速直线运动,加速度大小是2400km/h2,途中匀速行驶,速度为120km/h。
(18分)一位旅客可用三种方法从自贡到泸州:第一种是乘普客汽车经邓关、赵化到达。第二种是乘快客汽车经内江、隆昌的高速公路到达。第三种是乘火车到达。右面是三种车的发车时刻及里程表。已知普客汽车全程平均速度大小为60km/h,快客汽车全程平均速度大小为100km/h,两车途中均不停站,火车在中途需停靠内江站和隆昌站各5min,设火车进站和出站都做匀变速直线运动,加速度大小是2400km/h2,途中匀速行驶,速度为120km/h。
若现在时刻是上午8点05分,这位旅客想早点赶到泸州,请你通过计算说明他该选择乘座什么车?

24.(16分)对天体而言,若取物体离天体无穷远引力势能为零,则物体由于受天体引力作用而具有的重力势能可用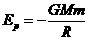 计算,其中G为万有引力恒量,m为物体质量,M为天体质量,R为物体到天体中心的距离,已知地球半径R0=6.4×106m,地球表面重力加速度g0=9.8m/s2,月球绕地球公转的轨道半径r=60R0,现要发射一颗与月球具有相同轨道的地球卫星,其发射速度应为多少?(取两位有效数字,忽略空气阻力及其他天体对卫星的作用)
计算,其中G为万有引力恒量,m为物体质量,M为天体质量,R为物体到天体中心的距离,已知地球半径R0=6.4×106m,地球表面重力加速度g0=9.8m/s2,月球绕地球公转的轨道半径r=60R0,现要发射一颗与月球具有相同轨道的地球卫星,其发射速度应为多少?(取两位有效数字,忽略空气阻力及其他天体对卫星的作用)
25. (20分)空间存在着以x=0平面为分界面的两个匀强磁场,左右两边磁场的磁感应强度分别为B1和B2,且B1:B2=4:3,方向如图所示。现在原点O处一静止的中性原子,突然分裂成两个带电粒子a和b,已知a带正电荷,分裂时初速度方向为沿x轴正方向,若a粒子在第四次经过y轴时,恰好与b粒子第一次相遇。求:
(20分)空间存在着以x=0平面为分界面的两个匀强磁场,左右两边磁场的磁感应强度分别为B1和B2,且B1:B2=4:3,方向如图所示。现在原点O处一静止的中性原子,突然分裂成两个带电粒子a和b,已知a带正电荷,分裂时初速度方向为沿x轴正方向,若a粒子在第四次经过y轴时,恰好与b粒子第一次相遇。求:
(1)a粒子在磁场B1中作圆周运动的半径与b粒子在磁场B2中圆周运动的半径之比。
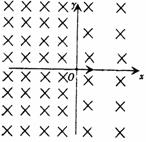 (2)a粒子和b粒子的质量之比。
(2)a粒子和b粒子的质量之比。
26. (14分)A-L所代表的各物质是中学化学里常见的物质,已知B、J是单质,A是化合物,E的溶液跟苯酚溶液混合,溶液呈紫色。A-L各物质之间相互反应转化关系如下图所示,请回答:
(14分)A-L所代表的各物质是中学化学里常见的物质,已知B、J是单质,A是化合物,E的溶液跟苯酚溶液混合,溶液呈紫色。A-L各物质之间相互反应转化关系如下图所示,请回答:
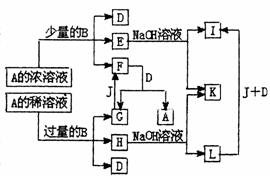
(1)(4分)B在A的浓溶液中反应的条件是___________________,常温下B在A的浓溶液中难以溶解的原因是_____________________________。
(2)(6分)写出下列化学方程式:
F→G+A _________________________________________________________________。
G→F____________________________________________________________________。
E→I的离子方程式________________________________________________________.
(3)(4分)L转化成I的现象是___________________________________________;
其化学方程式为__________________________________________________________。
27. (20分)某实验小组拟用50mL NaOH溶液吸收CO2气体,制备Na2CO3溶液。为了防止通入的CO2气体过量生成NaHCO3,设计了如下实验步骤:
(20分)某实验小组拟用50mL NaOH溶液吸收CO2气体,制备Na2CO3溶液。为了防止通入的CO2气体过量生成NaHCO3,设计了如下实验步骤:
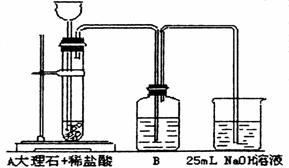
①用25mL NaOH溶液吸收CO2气体,至CO2气体不再溶解;
②小火煮沸溶液1 min-2min;
③在得到的溶液中加入另一半(25mL)NaOH溶液,使其充分混合。
此方案能制得较纯净的Na2CO3(第一步的实验装置如图所示)。
(1)(3分)将块状大理石加入试管中的正确方法是_____________________________
____________________________________________________________________________。
(2)(4分)写出①、③两步的化学反应程式__________________________________
____________________________________________________________________________。
(3)(4分)装置B中盛放的试剂是_______________,作用是_________________。
(4)(4分)有人认为将实验步骤②、③的顺序对调,即先混合再煮沸,更合理。你认为对吗?___________(填“对”或“不对”)。理由______________________________
____________________________________________________________________________。
(5)(2分)此实验中的装置A还可以作为下列___________________气体的发生装置(填序号,多填倒扣分)
①NH3 ②H2 ③C2H4
(6)(3分)实验室中吸收尾气的方法很多。下列装置中可以用来吸收氨气的是(填序号,多填倒扣分)____________________。
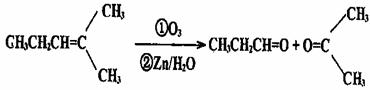
28. (14分)烯烃通过臭氧化并经锌和水处理得到醛或酮。例如:
(14分)烯烃通过臭氧化并经锌和水处理得到醛或酮。例如:
(1)(2分)已知丙醛的燃烧热为1815kJ/mol,试写出丙醛燃烧的热化学方程式:
_____________________________________________________________________________
(2)(12分)上述反应可用来推断烯烃的结构。一种链状单烯烃A通过臭氧化并经锌和水处理得到B和C。化合物B含碳69.8%、含氢11.6%,B无银镜反应,催化加氢生成D。D在浓硫酸存在下加热,可得到能使溴水褪色且只有一种结构的物质E。反应图示如下:
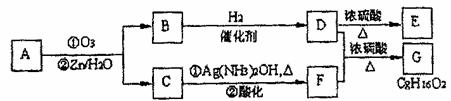
回答下列问题:
①(6分)B的相对分子质量是________________;C→F的反应类型为_____________;D中含有官能团的名称_______________________________________________________。
②(2分)D+F→G的化学方程式是:
____________________________________________________________________________。
③(2分)A的结构简式为_________________________________________________。
④(2分)化合物A的某种同分异构体通过臭氧氧化并经锌和水处理只得到一种产物,符合该条件的异构体的结构简式有__________________种。
29. (12分)某复盐的组成可表示为:xA2R·yBR·zH2O,R为-2价含氧酸根,为了确定该盐的组成,进行如下实验:
(12分)某复盐的组成可表示为:xA2R·yBR·zH2O,R为-2价含氧酸根,为了确定该盐的组成,进行如下实验:
①准确称取4.02g样品加热到失去全部结晶水,冷却后称量,质量为2.94g。
②将剩余固体溶于适量水,滴加盐酸,无现象,再滴加足量Ba(NO3)2溶液,产生白色沉淀,过滤,将沉淀烘干,称质量为4.66g。
③向上述溶液中加入过量NaOH溶液,产生白色沉淀,过滤,将沉淀烘干,称质量为0.58g,再将固体高温灼烧后冷却,称得剩余固体质量是0.40g。
请通过计算回答下列问题:
(1)(2分)确定R的化学式。R的化学式为________________________________。
(2)(2分)B元素的名称是_______________________________________________。
(3)(3分)求x、y、z的值:x=___________,y=___________,z=____________。
(4)(2分)A元素的名称是________________________________。
(5)(3分)该复盐的化学式为______________________________。
30. (20分)
(20分)
已知豌豆中存在矮生型突变体,它们表现为节间缩短的性状,成熟时植株高度只能达到正常植株20%-25%。但施用外源赤霉素能使矮生型突变体恢复到正常的野生型的高度。为了验证这一结论,请你根据以下实验材料和用具,写出实验步骤、实验结果和实验结论,并回答有关问题。
实验材料和用具:
生长状况相似的矮生型突变豌豆幼苗和生长状况相似的正常野生型豌豆幼苗若干株、蒸馏水、5×10-10mol·L-1赤霉素溶液、直尺等。
实验步骤:
(1)___________________________________________________________________
___________________________________________________________________________。 (2)__________________________________________________________________
___________________________________________________________________________。 (3)___________________________________________________________________
___________________________________________________________________________。
实验结果:_____________________________________________________________
___________________________________________________________________________。
实验结论:_____________________________________________________________
___________________________________________________________________________。
有人认为用外源生长素代替外源赤霉素也能达到同样的效果,请你作出判断并说出相应的理由:____________________________________________________________________
___________________________________________________________________________。

31.(22分)
回答下列(1)、(2)两小题
(1)鸡冠的形状由两对基因(A和a,B和b)控制,这两对基因按自由组合定律遗传,与性别无关。据下表回答问题:
|
项目 |
基因组合 |
A_B_型 |
A_bb型 |
aaB_型 |
aabb型 |
|
鸡冠形状 |
核桃状 |
玫瑰状 |
豌豆状 |
单片状 |
|
|
杂交 组合 |
甲:核桃状×单片状→F1:核桃状,玫瑰状,豌豆状,单片状 |
||||
|
乙:玫瑰状×玫瑰状→F1:玫瑰状,单片状 |
|||||
|
丙:豌豆状×玫瑰状→F1:全是核桃状 |
①甲组杂交方式在遗传学上称为___________________;甲组杂交F1代四种表现型比例是__________________________________________________。
②让乙组后代F1中玫瑰状鸡冠的与另一纯合豌豆状鸡冠的杂交,杂交后代表现型及比例在理论上是__________________________________。
③让丙组F1中的雌雄个体交配,后代表现为玫瑰状鸡冠的有120只,那表现为豌豆状的杂合子理论上有__________________只。
④基因型为AaBb与Aabb的个体杂交,后代中纯合子比例占________________。
(2)20世纪初,科学家弗莱明在实验中偶然发现,被其他细菌污染的培养皿中,青霉菌菌落周围一圈区域内其他细菌不能生存。后来经提纯分析,发现了青霉素。
①请在下图中找出能表示青霉菌与细菌(如肺炎双球菌)之间关系的坐标曲线,并说明理由。

你选择的曲线图是__________,理由是__________________________。
②在生态系统中,像青霉菌这样的生物有什么重要意义?
________________________________________________________________________。
③野生青霉菌的青霉素产量较低,人们对青霉菌进行X射线、紫外线照射等技术处理,培育出了能遗传的高产菌株,但该育种方法也有缺点,即__________________________
___________________________________________________________________________。
④青霉菌对大粒肠杆菌效力不高,是因为大肠杆菌的某种质粒中含有青霉素抗性基因。假如用该质粒作运载体进行基因转移,如何检验目的基因是否成功的转入到受体细菌的细胞中?
___________________________________________________________________________
___________________________________________________________________________。
自贡市2006级诊断性考试理科综合能力测试答案
第I卷 (选择题 共126分)
(一)请从以上仪器及元件中选择出合适的仪器或元件
直流电流表_____________,直流电压表______________,电源_______________
14.一物体在两个力作用下静止,若使其中一个力不变,另一力逐渐减小到零,再按原方向逐渐恢复到原值,则物体在此过程中的运动情况是
A.一直加速 B. 一直减速
C.先加速后减速 D. 先减速后加速
15.联合国环境公署对科索沃地区的调查表明,北约对南联盟进行轰炸中,大量使用了贫铀炸弹。贫铀炸弹是一种杀伤力很强的武器,贫铀是提炼铀235以后的副产品,其主要成份为铀238。贫铀炸弹不仅有很强的穿甲能力,而且铀238具有放射性,残留物可长期对环境起破坏作用造成污染。人长期生活在该环境中会受辐射而患上皮肤癌和白血病。以下说法正确的是
A.铀238的衰变方程为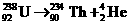 B. 铀238衰变的半衰期很短
B. 铀238衰变的半衰期很短
C.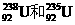 互称为同位素
互称为同位素
D.人患皮肤癌和白血病是因为核辐射导致了基因突变
16.微波炉是一种新型灶具,炉内产生的微波可使食物中分子高频运动从而加热食物。下列关于微波的说法正确的是
A.微波是由原子的内层电子受到激发而产生的
B.微波的频率小于紫外线的频率
C.微波比可见光更容易产生衍射现象
 D.微波比X射线更容易产生光电效应现象
D.微波比X射线更容易产生光电效应现象
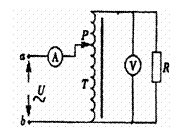
17.在如右图所示的电路中,T为理想的调压变压器,A、V是理想的交流电表,在ab之间接上电压有效值保持不变的正弦交流电源,若将调压变压器的滑动触头P向下移动一些,则
A.电流表A的示数变小
B.电流表A的示数不变
C.电压表V的示数变大
D.变压器的输入功率变大
|
|


 B.Q3为负电荷,且放于B右方
B.Q3为负电荷,且放于B右方
C.Q3为正电荷,且放于AB之间
 D.Q3为正电荷,且放于B右方
D.Q3为正电荷,且放于B右方
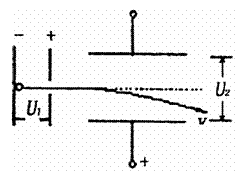
19.如右图所示,电子在电势差为U1的电场中加速后,垂直射入电势差为U2的偏转电场,在满足电子能射出偏转电场且偏转极板不改变的条件下,下列四种情况中,一定能使电子的偏转角变大的是
A.U1变大、U2变大
B.U1变小、U2变大
C.U1变大、U2变小
 D.U1变小、U2变小
D.U1变小、U2变小
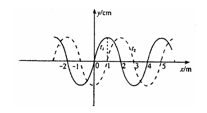
20.一简谐横波在右图中x轴上传播,实线和虚线分别是t1和t2时刻的波形图,已知t2 - t1=1.0s。由图判断其波速可能是
A. 1m/s B. 3m/s C. 4m/s D. 7m/s
21. 如右图所示,绝热隔板K把绝热的气缸分隔成体积相等的两部分,K与气缸壁的接触是光滑的。两部分中分别盛有相同质量、相同温度的同种气体a和b。气体分子之间相互作用势能可忽略。现通过电热丝对气体a加热一段时间后,a、b各自达到新的平衡,则
如右图所示,绝热隔板K把绝热的气缸分隔成体积相等的两部分,K与气缸壁的接触是光滑的。两部分中分别盛有相同质量、相同温度的同种气体a和b。气体分子之间相互作用势能可忽略。现通过电热丝对气体a加热一段时间后,a、b各自达到新的平衡,则
A.a的体积增大了,压强变小了
B.b的温度升高了
C.加热后a的分子热运动比b的分子热运动更激烈
D.a增加的内能小于b增加的内能
自贡市普高2006级诊断性考试
理科综合能力测试题
第II卷(非选择题共174分)

22.(18分)(1)“探究弹力和弹簧伸长的关系”的实验中,选用的螺旋弹簧如下图1所示。
①用螺旋测微器测量弹簧A处钢丝的直径的示数如图2所示。可知此弹簧钢丝的直径是____________________m。
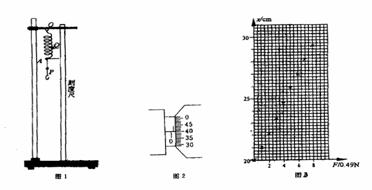
②将弹簧的上端O点固定悬吊在铁架台上,旁边置一刻度尺,刻度尺的零刻线跟O点对齐,在弹簧的下部A处做一标记,如固定一个指针。在弹簧下端的挂钩上挂上钩码(每个钩码的质量都是50g),指针在刻度尺上指示的刻度为x。逐个增加所挂钩码的个数,刻度x随挂钩上的钩码的重量F而变化,几次实验测得相应的F、x各点描绘在图3中。请在图3中描绘出x随F变化的图像。由图像得出弹簧的劲度系数kA=________N/m。(结果取2位有效数字);此弹簧的弹力大小F弹跟弹簧伸长△x的关系是_________________。
③如果将指针固定在A点的下方P处,再做出x随F变化的图像,得出弹簧的劲度系数与kA相比,可能是( )。
A.大于kA B. 等于kA C. 小于kA D. 无法确定
④如果将指针固定在A点的上方Q处,再做出x随F变化的图像,得出弹簧的劲度系数kA相比,可能是( )。
A.大于kA B. 等于kA C. 小于kA D. 无法确定
(2)用伏安法测定一个阻值约为25kΩ,额定功率为5.0×10-3W的电阻的阻值,要求被测电阻在额定功率附近使测量值达到尽可能高的精确度,备用仪器及元件为
①待测电阻:Rx
②直流电流表:A1:量程0-100μA,内阻约为2kΩ;
A2:量程0-500μA,内阻约为300Ω;
③直流电压表:V1:量程0-1V,内阻约为1kΩ;
V2:量程0-10V,内阻约为100kΩ;
V3:量程0-50V,内阻约为500kΩ;
④电源: E1:两节干电池,每节1.5V;
E2:直流稳压电源,输出电压15V,额定电流1A;
E3:直流稳电电源,输出电压50V,额定电流0.5A。
以上电源内阻忽略不计
⑤滑线变阻器R0,最大阻值1kΩ,额定功率1W
⑥电键、导线若干
13.1702年德国化学家Georg Stahl最先发现并报道了高铁酸钠,随后对高铁酸钠的研究报道一直没有中断过。研究表明Na2FeO4是一种高效多功能水处理剂,应用前景广阔。一种制备Na2FeO4的方法可用化学方程式表示如下:
2FeSO4+6Na2O2=2Na2FeO4+2Na2O+2Na2SO4+O2↑
对此反应下列说法中不正确的是
A.O2是氧化产物
B.Na2FeO4既是氧化产物又是还原产物
C.2mol FeSO4发生反应时,共有10mol电子转移
D.Na2O2在反应中只作氧化剂
12.科学界拟合成一种“双重结构”的球形分子,即把足球烯C60分子容纳在Si60分子中,外面的硅原子与里面的碳原子以共价键结合。下列有关叙述正确的是
A.该物质是一种新型化合物 B. 该反应属于置换反应
C.该晶体属于原子晶体 D. 该物质具有极高的熔沸点
11.有关晶体的说法正确的是
A.晶体中分子间作用力越大,分子越稳定
B.原子晶体中共价键越强,熔点越高
C.冰融化时水分子中共价键发生断裂
D.氯化钠熔化时离子键不会被破坏
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com