
题目列表(包括答案和解析)
4.分类方法在化学学科的发展中起到了非常重要的作用。下列分类标准合理的是
①根据酸分子中含有的H原子个数将酸分为一元酸、二元酸等
②根据反应中是否有电子的转移将化学反应分为氧化还原反应和非氧化还原反应
③根据分散系是否具有丁达尔现象将分散系分为溶液、胶体和浊液
④根据反应中的热效应将化学化学反应分为放热反应和吸热反应
A.①③ B.②④ C.①②④ D.②③④
3.用NA表示阿伏加德罗常数的值,下列说法正确的是
A.60.0g二氧化硅晶体中,含有“Si-O”键的数目为NA
B.34g过氧化氢分子中极性共价键的数目为NA
C.标准状况下,22.4L甲烷和氨气的混合气体所含有的电子总数约为10NA
D.1molT2气体分子(超重氢分子)中所含的中子总数为2NA
2.根据下表中列出的数据,判断下列热化学方程式书写不正确的是
|
化
学 键 |
H-H |
Cl-Cl |
H-Cl |
|
生成1mol化学键时放出的能量 |
436kJ·mol-1 |
243kJ·mol-1 |
431kJ·mol-1 |
A.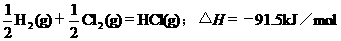
B.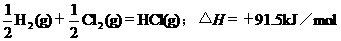
C.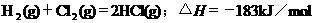
D.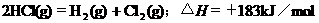
1.下列说法正确的是
A.碱金属从上到下熔沸点逐渐降低,密度逐渐增大,硬度逐渐减小
B.第三周期金属从左到右金属性逐渐减小,硬度逐渐减小,
C.钠既是常见金属,又是有色金属,还是轻金属,
D.明矾是一种净水剂,经它净化的水是软水
17. 在一个固定容积的密闭容器中, 保持一定的温度, 在一定条件下进行以下反应: A(气)
+ 2B(气)  3C(气), 已知加入1mol A和3mol
B, 生成了amol C:
3C(气), 已知加入1mol A和3mol
B, 生成了amol C:
(1) 达到平衡时C在反应混合气体中的百分含量是 _______(用含有a的关系式表示)
(2)在相同的实验条件下, 若在同一个容器中改为加入2mol A和6mol B, 达到平衡后, C的物质的量为 ______ mol, 此时C在混合气体中的百分含量 ________(填写增大、减小或不变)
(3)在相同实验条件下, 若在同一容器中加入2mol A和8mol B, 若要求平衡后C在混合气体中的百分含量保持不变, 则还应该加入C ________ mol
(4)在同一个容器中加入nmol A和3nmol B, 则平衡时C的物质的量为m mol, 若改变实验条件, 可以使C的物质的量在m-2m之间变化, 那么, n与m的关系是 _____(用含有n和m的关系式表示.
一个容积固定的反应容器中, 有一可以左右滑动的密封隔板, 两侧分别进行如下图所示的可逆反应:
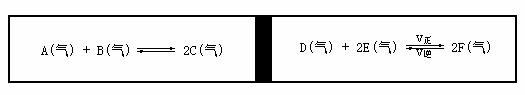
各物质的起始加入量如下: A、B、C 均为 4.0 mol, D为 6.5 mol, F为 2 mol, 设E 为 x mol, 当x 在一定范围内变化时, 均可以通过调节反应器的温度时两侧反应都达到平衡, 且隔板恰好处于反应器的正中位置, 请填写下列空白:
(1) 当x = 4.5时, 则右侧反应起始时向 ________ (填 “正反应” 或 “逆反应”), 要使起始反应维持向该方向进行, x 的最大值应小于 _______________.
(2) 若x 分别为 4.5 和 5.0, 则在这两种情况下, 当反应达到平衡时, A的物质的量 ____(填写相等、不相等或不能确定), 请解释理由 ___________________.
(3) x = 3.0时, 右侧反应在起始时向 ___________ (填 “正反应” 或 “逆反应”), 要使起始反应维持向该方向进行, x 的最小值应大于 _______________.
(4) x = 4.5时, 左右两侧反应体系达到平衡后, 向左侧反应器中充入a mol A气体, 当左右两侧再次达到平衡状态时, 求a 的取值范围.
(5) 当x 变动时, D的最大转化率为多少.
(6) 当x变动时, 则起始时D和E的物质的量的比值的取值范围为多少.
(7) 当x = 4.5时, 且左右两侧反应体系均达到平衡状态后, 向右侧反应器中充入a mol 的Ar气, 则求a 的最大取值.
(1)正反应 7.0 (2)不相等 因为这两种情况是在两个不同温度下达到化学平衡的,平衡状态不同,所以物质的量也不同。(3) 逆反应 2.5 (4)0-2 (7)1.25
16.已知T°、pkpa时,在容积为vL的密闭容器内充有1molA和1molB。保持恒温、恒压反应A(g)+B(g) C(g)达到平衡时,C的体积分数为40%。试回答有关问题。
(1)欲使温度和压强在上述条件下恒定不变,在密闭容器内充入2molA 2molB,则反应达到平衡时,容器的容积为 ,C的体积分数为 。
(2)若另选一容积固定不变的密闭容器,仍控制温度为T℃,使1molA和1molB反应达到平衡状态时,C的体积分数仍为40%,则该密闭容器的容积为 。
10/7VL 40% 5/7VL
15. 在一个盛有催化剂容积可变的密闭容器中,保持一定的温度和压强,进行以下反应:N2+3H2 2NH3。已知加入1molN2和4molH2时,达到平衡后生成amolNH3。有恒温恒压下欲保持平衡时各组分的体积分数不变。填表(恒温恒压)
在一个盛有催化剂容积可变的密闭容器中,保持一定的温度和压强,进行以下反应:N2+3H2 2NH3。已知加入1molN2和4molH2时,达到平衡后生成amolNH3。有恒温恒压下欲保持平衡时各组分的体积分数不变。填表(恒温恒压)

(1)1.5a
(2)0 0.5
(3)2(g-4m)
a(g-3m)
14.
 将2molH2O(g)和1molBr2(g)置于1L的密闭容器中,在一定条件下加热至较高温度,发生如下可逆反应(忽略其它反应):2H2O(g) 2H2(g)+ O2(g) H2(g)+Br2(g) 2HBr(g)
将2molH2O(g)和1molBr2(g)置于1L的密闭容器中,在一定条件下加热至较高温度,发生如下可逆反应(忽略其它反应):2H2O(g) 2H2(g)+ O2(g) H2(g)+Br2(g) 2HBr(g)
(1)当上述系统达到平衡后,测得c(H2O)平=0.6 mol·L-1,c(Br2)平=0.6 mol·L-1,则平衡时c(H2)平= mol·L-1
(2)若平衡时c(H2)平=a mol·L-1,c(HBr)平=b mol·L-1,则平衡时混合气体的密度是相同条件下H2密度的 倍。
(3)当上述系统达到平衡时,欲求其混合气体的平衡组成,则至少还需知道两种气体的平衡浓度,但这两种气体不能同时是 和 ,或 和 (填化学式)。
(1)1.0 (2)196/(6+a+0.5b) H2O O2 Br2 HBr
13.在一定温度下,向一个容积不变的容器中,加入3molSO2和2molO2 及固体催化剂,使之反应。2SO2(g) + O2 (g) 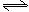 2SO3 (g) ;△H=-196.6kJ/mol。平衡时容器内气体压强为起始时的90%。此时
2SO3 (g) ;△H=-196.6kJ/mol。平衡时容器内气体压强为起始时的90%。此时
Ⅰ、加入3molSO2和2molO2 发生反应,达到平衡时,放出的热量为 。
Ⅱ、保持同一反应温度,在相同的容器中,将起始物质的量改为amolSO2、bmolO2、cmolSO3(g),欲使平衡时SO3的体积分数为2/9 ,
①达到平衡时,Ⅰ与Ⅱ放出的热量 (填序号)。
A、一定相等 B、前者一定小 C、前者大于或等于后者
②a、b、c必须满足的关系是(一个用a、c表示,另一个用b、c表示) 、 。
③欲使起始时反应表现为向正反应方向进行,a的取值范围是: 。
Ⅰ、 98.3kJ (2分)
Ⅱ、①C (1分) ② a +c=3,2b+c=4(每式1分,共2分) ③2<a≤3(2分)
12.将1molCO和1molH2O(g)充入某固定容积的反应器中,在某条件下达到平衡:
CO+H2O(g)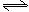 CO2+H2,此时有2/3的CO转化为CO2。
CO2+H2,此时有2/3的CO转化为CO2。
⑴该平衡混合物中CO2的体积分数为
⑵若在相同条件下,向容器中充入1molCO2、1molH2和1molH2O,则达到平衡时与⑴中平衡相比较,平衡应向 (填“正反应方向”、“逆反应方向”或“不”)移动,此时平衡混合物中CO2的体积分数可能是下列各值中的 (填编号)
A.22.2% B.27.55% C.33.3% D.36.8%
⑶结合⑵中计算结果分析若平衡向正方向移动时,则下列说法中正确的是 (填序号)
①生成物的产量一定增加;②生成物的体积分数一定增加;③反应物的转化率一定增大;④反应物的浓度一定降低;⑤正反应速率一定大于逆反应速率;⑥一定使用了催化剂
(1)33.3%(2)正反应,B(3)①⑤
解析:(2)中的投料相当于投入了CO1mol,H2O1mol,增大了H2O的浓度,平衡向正方向移动,所以CO的转化率增大。解题时可运用极限思维的方法:若CO仍只有2/3转化,计算可得平衡混合物中CO2的体积分数为22.2%;若CO全部转化,计算可得CO2的体积分数为33.3%。因此实际情况应介于二者之间。故选B。
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com