
题目列表(包括答案和解析)
25.某化学兴趣小组,专门研究了氧族元素及其某些化合物的部分性质。所查资料如下:
(1)碲(Te)为固体,H2Te为气体,Te和H2不能直接化合生成H2Te
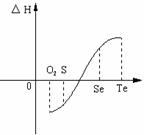 (2)等物质的量氧气、硫、硒、碲与H2反应的焓变情况如图所示:
(2)等物质的量氧气、硫、硒、碲与H2反应的焓变情况如图所示:
请回答下列问题:
(1)H2与硫化合的反应 热量(填“放出”或“吸收”)。
(2)根据题目所给信息,请解释为什么Te和H2不能直接化合
。
(3)H2S的水溶液显弱酸性,写出其电离方程式 ;在一定温度下,它的第一级电离常数可用 Ka表示,Ka 值越大,表示________________,Ka值大小与温度的关系是:温度升高,Ka 值_________(填“一定增大”、“一定减小”、或“可能增大也可能减小”)。
(4)在容积均为1 L(容器体积不可变)的甲、乙两个容器中,分别加入2 mol SO2、
1 mol O2 和4 mol SO2、2 mol O2,在相同温度、催化剂下使其反应。最终达到平衡后,两容器中SO2转化率分别为α甲、α乙,甲容器中平衡常数表达式为 ,此时α甲 α乙(填“大于”、“小于”或“等于”)。
24.化学中用类比的方法可预测许多物质的性质。
如根据H2+Cl2 2HCl 推测:H2+Br2
2HCl 推测:H2+Br2 2HBr。但类同是相对的,如根据2Na2O2+2CO2
2HBr。但类同是相对的,如根据2Na2O2+2CO2 2Na2CO3+O2 类推:2Na2O2+2SO2
2Na2CO3+O2 类推:2Na2O2+2SO2 2Na2SO3+O2是错误的,应该为:Na2O2+SO2
2Na2SO3+O2是错误的,应该为:Na2O2+SO2 Na2SO4。
Na2SO4。
⑴下列各组类比中正确的是 。
A.NH4Cl NH3↑+HCl 推测:NH4I
NH3↑+HCl 推测:NH4I NH3↑+HI↑
NH3↑+HI↑
B.由CO2+Ca(ClO)2+H2O CaCO3↓+2HClO
推测:SO2+Ca(ClO)2+H2O
CaCO3↓+2HClO
推测:SO2+Ca(ClO)2+H2O CaSO3↓+2HClO
CaSO3↓+2HClO
C.由2CO2+Ca(ClO)2+2H2O Ca(HCO)2+2HClO推测:CO2+NaClO+H2O
Ca(HCO)2+2HClO推测:CO2+NaClO+H2O NaHCO3+HClO
NaHCO3+HClO
D.由Na2SO3+2HCl 2NaCl+H2O+SO2↑ 推测:Na2SO3+2HNO3
2NaCl+H2O+SO2↑ 推测:Na2SO3+2HNO3 2NaNO3+H2O+SO2↑
2NaNO3+H2O+SO2↑
⑵根据2Na +
2H2O 2NaOH + H2↑的反应推断Na与液NH3反应的方程式为:
2NaOH + H2↑的反应推断Na与液NH3反应的方程式为:
________________________________________________________________。
⑶由氢氧化铁与盐酸反应生成氯化铁和水,应用有关化学知识,推断写出氢氧化铁与氢碘酸反应的化学方程式_________________________________________________________。
⑷从2F2+2H2O 4HF+O2反应预测2F2+4NaOH
4HF+O2反应预测2F2+4NaOH 4NaF+2H2O+O2,然而经实验,物质的量相等的氟气和氢氧化钠正好完全反应,生成氟化钠、水和放出一种气体,请根据实验结果写出化学反应方程式__________________________________________________。
4NaF+2H2O+O2,然而经实验,物质的量相等的氟气和氢氧化钠正好完全反应,生成氟化钠、水和放出一种气体,请根据实验结果写出化学反应方程式__________________________________________________。
22.某化学兴趣小组按照下列方案进行“由含铁废铝制备硫酸铝晶体”的实验:
步骤1:取一定量含铁废铝,加足量的NaOH溶液,反应完全后过滤。
步骤2:边搅拌边向滤液中滴加稀硫酸至溶液的pH=8-9,静置、过滤、洗涤。
步骤3:将步骤2中得到的固体溶于足量的稀硫酸。
步骤4:将得到的溶液蒸发浓缩、冷却、结晶、过滤、干燥。
请回答以下问题:
⑴上述实验中的过滤操作需要玻璃棒、____________、____________等玻璃仪器。
⑵步骤1过滤的目的是_________________________________________。
⑶当步骤2中的溶液pH=8-9时,检验沉淀是否完全的方法是______________________。
⑷步骤2中溶液的pH控制较难操作,可改用________________ ____。
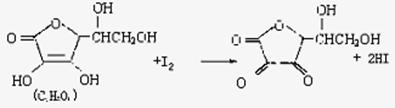 23.维生素C(水溶液呈酸性)具有明显的抗衰老作用,但易被空气氧化。新鲜水果蔬菜、乳制品中都富含维生素C。如新鲜橙汁中维生素C的含量在500mg/L左右。某课外小组利用碘滴定法测某橙法中维生素C的含量,其反应原理为:
23.维生素C(水溶液呈酸性)具有明显的抗衰老作用,但易被空气氧化。新鲜水果蔬菜、乳制品中都富含维生素C。如新鲜橙汁中维生素C的含量在500mg/L左右。某课外小组利用碘滴定法测某橙法中维生素C的含量,其反应原理为:
(1)下列说法中正确的是( )
A.上述反应为取代反应 B.滴定时可用淀粉溶液作指示剂
C.滴定时可用甲基橙作指示剂 D.锥形瓶不能用待测橙汁润洗
(2)上述实验前要配制7.50×10-3mol/L的标准碘溶液100mL。除玻璃棒外,还需要的玻璃仪器有 等(填编号)
A.容量瓶 B.烧杯 C.锥形瓶 D.烧瓶
(3)标准碘液放入 (填仪器名称),滴定时,眼睛注视 ,直到滴定终点。滴定至终点的现象是 。
(4)滴定过程中能否剧烈摇动锥形瓶 (填“能”或“不能”),为什么
。
(5)若经数据处理,滴定中消耗的标准碘溶液的体积是15.00mL,锥形瓶中注入的待
测橙汁是20.00mL,则此橙汁中维生素C的含量是 mg/L,该橙汁 (填“是”
或“不是”)纯天然的新鲜橙汁。
21.某学生为了将含有少量杂质(铜粉)的氯化铁提纯,拟定以下实验步骤:
a.把样品加水溶解,b.过滤 c.把滤液加热蒸干,得到FeCl3固体,试回答:
(1) 以上设计 科学的(填是或不是),理由是
。
(2) 请你设计和完善提纯FeCl3的方案:.
①把样品加水溶解,② ,③过滤,④ ,
⑤ ,⑥把滤液加热蒸发结晶,得FeCl3固体。
20.在一密闭容器中有如下反应:aX(g)+bY(g) 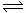 nW(g);ΔH=Q
nW(g);ΔH=Q
某化学兴趣小组的同学根据此反应在不同条件下的实验数据,作出了如下曲线图:
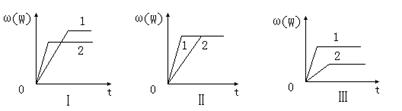
其中,ω(W)表示W在反应混合物中的百分含量,t表示反应时间。其它条件不变时,下
列分析可能正确的是
A.图Ⅰ可能是不同压强对反应的影响,且P2>P1,a+b<n
B.图Ⅱ可能是在同温同压下催化剂对反应的影响,且1使用的催化剂效果好
C.图Ⅱ可能是不同压强对反应的影响,且P1>P2,n<a+b
D.图Ⅲ可能是不同温度对反应的影响,且T1>T2,Q<0
第Ⅱ卷 (非选择题,共60分)
19.近年来珠海建设了多个主题广场,为市民提供了夏夜纳凉的好去处,夜色中常看到小
朋友手持被称为“魔棒”的荧光棒玩耍,“魔棒”发光原理是利用过氧化氢氧化草酸二酯
产生能量,该能量被传递给荧光物质后便发出荧光,草酸二酯(CPPO)结构简式为
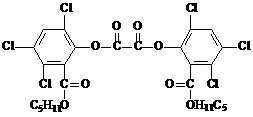
下列有关说法正确的是
A.草酸二酯属于芳香族化合物
B.草酸二酯属于高分子化合物
C.1mol草酸二酯与氢氧化钠稀溶液反应(苯环上卤素不水解),最多消耗4molNaOH
D.1mol草酸二酯与氢气完全反应,需要氢气10mol
18.下列叙述正确的是
A.0.01mol/LCH3COOH与pH=12的NaOH溶液混合,若有c(CH3COO-)>c(Na+),则混合液
一定呈碱性
B.常温下,将等体积0.01mol/LHCl与pH=12的氨水混合,则混合液的pH=7
C.0.1mol/L的某二元弱酸盐Na2A溶液中,c(Na+)=2c(H2A)+2c(HA‑)+2c(A2-)
D.将5 mL 0.02mol/L的H2SO4与5 mL 0.02mol/LNaOH溶液充分混合,若混合后溶液的体积为10mL,则混合液的pH=2
17.将氢气、甲烷、乙醇等物质在氧气中燃烧时的化学能直接转化为电能的装置叫燃料电
池。燃料电池的基本组成为电极、电解质、燃料和氧化剂。此种电池能量利用率可高达80%
(一般柴油发电机只有40%左右),产物污染也少。下列有关燃料电池的说法错误的是
A.上述燃料电池的负极反应材料是氢气、甲烷、乙醇等物质
B.氢氧燃料电池常用于航天飞行器,原因之一是该电池的产物为水,经过处理之后可
供宇航员使用
C.乙醇燃料电池的电解质常用KOH,该电池的负极反应为C2H5OH-12e-=2CO2↑+3H2O
D.甲烷燃料电池的正极反应为O2+2H2O+4e-=4OH-
16.在pH为4-5的环境中,Cu2+、Fe2+不生成沉淀,而Fe3+几乎完全沉淀。工业上制
CuCl2是将浓盐酸用蒸汽加热到80℃左右,再慢慢加入粗氧化铜(含杂质FeO),充分搅拌
使之溶解。欲除去溶液中的杂质离子,下述方法正确的是
A.加入纯Cu将Fe2+还原 B.向溶液中加入(NH4)2S使Fe2+沉淀
C.直接加水加热使杂质离子水解除去 D.在溶液中通入Cl2,再加入CuO调节pH为4-5
15.从下列事实所列出的相应结论正确的是
|
|
实
验 事
实 |
结 论 |
|
A |
Cl2的水溶液可以导电 |
Cl2是电解质 |
|
B |
SO2通入硝酸钡溶液出现白色沉淀 |
BaSO3不溶于强酸 |
|
C |
NaHCO3溶液与NaAlO2溶液混合产生白色沉淀 |
酸性:HCO3->Al(OH)3 |
|
D |
常温下白磷可自燃而氮气须在放电时才与氧气反应 |
非金属性:P>N |
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com