
题目列表(包括答案和解析)
1.下列关于石油的叙述正确的是
A.其组成按聚集状态分析,主要是由液态、气态、固态烃等组成的混合物,
B.其组成按烃的类别分析,主要是由烷烃、烯烃、芳香烃等组成的混合物,
C.其中C、H占所有元属组成的97%-98%,其用途只是生产燃料油,
D.石油是混合物,石油馏分是纯净物,因为前者呈褐色,后者是澄清的。
29.(14分) (1)NaOH溶液 (2分) (2)取代(或醇解)(2分)
(3) (2分)
(2分) 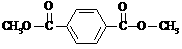 (2分)
(2分)
(4)m∶(m+n)∶n (2分)
(5) +3H2
+3H2

 (2分,未写反应条件不计分)
(2分,未写反应条件不计分)
CH2Br-CH2Br+2H2O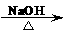
 HOCH2-CH 2OH+2HBr (2分,未写反应条件不计分)
HOCH2-CH 2OH+2HBr (2分,未写反应条件不计分)
28.(15分)(1)[方法一]
在装置B中加入适量NaOH溶液或水,浸没长导管,打开止水夹a,双手捂住烧瓶片刻或用洒精灯微热,若B中长导管中有气泡逸出,松开手后,导管中有水柱回升,则说明装置A气密性良好。
[方法二]
关闭止水夹a,在分液漏斗中加入适量水,打开玻璃塞,打开漏斗活塞,漏斗中先有少量水流出,稍后不再滴出。说明装置A气密性良好。
(其它正确、合理的操作均可酌情给分)(2分)
(2)NaOH溶液,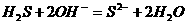 (2分)
(2分)
(3)先加入固体试剂HgO粉末,然后加入少量蒸馏水,再缓缓加入浓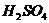 稀释。(2分)
稀释。(2分)
(4)水浴加热,将温度计置于烧杯中。(2分)
(5)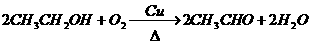 (2分)
(2分)
(Ⅱ) 或苯 ;(1分)
或苯 ;(1分)
其中最合理的方案是 丙 。(2分)
其它方案的不足是 甲:涤涤后未蒸馏,无法除去与溴苯相混溶的苯和三溴苯。乙:先有碱洗,溴化铁与碱反应生成难溶于水的氢氧化铁,很难再分离。(2分)
27.(15分)(1)氢、钠、氯; (2)H2O2+SO2=H2SO4;
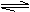 (3)2SO2(g)+O2(g) 2SO3(g);△H=-196.6kJ/mol;
(3)2SO2(g)+O2(g) 2SO3(g);△H=-196.6kJ/mol;
接触室;400-500℃,催化剂;
(4)使湿润的淀粉碘化钾试纸变蓝:Cl2+2OH-=ClO-+Cl-+H2O;Fe-2e-=Fe2+
26.(16分)(1)Ba(NO3)2 (1分) HCl (1分) HNO3(1分) Br2(1分) AgNO3(1分)
(2)SO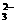 (1分) SO
(1分) SO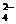 (1分) Cl-(1分)
(1分) Cl-(1分)
(3)BaSO3+2H+====Ba2++SO2↑+H2O(2分)
(4)中和OH-,防止对Cl-的检验产生干扰(2分)
(5)会使SO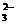 对SO
对SO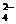 的检验产生干扰,不能确认SO
的检验产生干扰,不能确认SO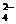 是否存在(2分)
是否存在(2分)
(6)SO2+Br2+2H2O====4H++SO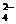 +2Br-(2分)
+2Br-(2分)
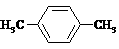
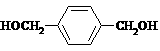
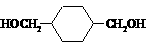
29.(14分)我国第二代身份证采用的是具有绿色环保性能的PETG新材料,PETG新材料
可以回收再利用,而且对周边环境不构成任何污染。这一材料是由江苏华信塑业发展有限公
司最新研发成功的新材料,并成为公安部定点产地。PETG的结构简式为:
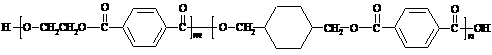
EG TPA CHDM TPA
已知:Ⅰ.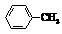
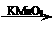

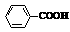
Ⅱ.RCOOR1+R2OH→RCOOR2+R1OH (R、R1、R2表示烃基)
这种材料可采用下列合成路线
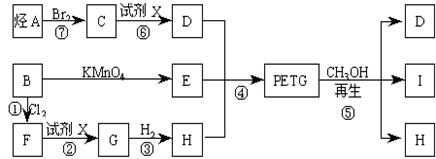
试回答下列问题:
(1)反应②、⑥中加入的试剂X是_____________________;
(2)⑤的反应类型是________________;
(3)写出结构简式:B______________________,I________________________;
(4)合成应控制单体的物质的量n(D):n(E):n(H)=_____:_____:_____(用m、n表示)。
(5)写出化学方程式:反应③:____________________________________________________;
反应⑥:_____________________________________________________。
28.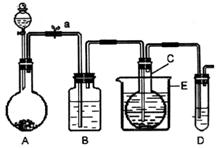 (15分)(Ⅰ)在75℃左右,实验室用HgSO4做催
(15分)(Ⅰ)在75℃左右,实验室用HgSO4做催
化剂,可使乙炔与水反应生成乙醛,资料提示
HgSO4遇到H2S等物质会发生催化剂中毒而失去
活性。供选用试剂:块状电石、HgO粉末、
浓H2SO4、NaOH溶液、蒸馏水装置图如下:
(夹持装置和热源均已省略)
回答下列问题:
(1)装入药品前,检验装置A气密性的简单操作方法
_________________________________________________________________。
(2)装置B中盛放的试剂为_____________,反应的离子方程式为
_________________________________________________________________。
(3)烧瓶C中应分别直接加入三种试剂,操作方法是
_________________________________________________________________。
(4)E装置的作用是_____________,尚需添加的仪器名称及位置__________________。
(5)该方法制乙醛纯度较高,但在操作中易发生汞中毒,不安全。再设计一种实验室制乙醛的方法,表示其反应原理的化学方程式为
_________________________________________________________________。
(Ⅱ)若用A、B、D装置相连(导管长短、数量可调整)进行苯与溴反应的实验。为验证反应产物,B装置中盛放的试剂为__________________________。
反应后得到的粗溴苯中溶有少量的苯、溴、三溴苯、溴化铁和溴化氢,下列是三个提纯方案:
甲:①水洗 ②碱洗 ③水洗 ④干燥
乙:②碱洗 ③水洗 ④干燥 ⑤蒸馏
丙:①水洗 ②碱洗 ③水洗 ④干燥 ⑤蒸馏
三者中最合理的方案是_____________。
其它方案的不足是______________________________________________________
_______________________________________________________________________。
27.(15分)有A、B、C、D、E、F六种元素,原子序数依次增大,位于不同的三个短周期,其中B与D可形成DB2、DB3化合物,在同周期元素中,C的金属性最强,E的非金属性最强;请回答:
(1)写出A、C、E三种元素的名称
A. C. E .
(2)A、B形成的化合物与DB2反应生成一种强酸的化学方程式为:
(3)已知DB2在一定条件下可转化为DB3,1mol DB2充分反应,放出98.3kJ的热量。该反应的热化学方程式是 ,工业上进行这一反应的设备是 ,反应的适宜条件为 。
(4)用铂作电极电解由C、E形成化合物的饱和溶液时,检验阳极产物的实验方法为
;电解一段时间后,将阳极产物和阴极溶液混合,反应的离子方程式是 。若改用铁棒做阳极材料,则阳极的电极反应式为 。
26.(16分)某无色溶液中含有K+、Cl-、OH-、SO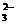 、SO
、SO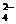 ,为检验溶液中所含的各阴离子,限用的试剂有:盐酸、硝酸、硝酸银溶液、硝酸钡溶液、溴水和酚酞试液。检验其中OH-的实验方法从略,检验其他阴离子的过程如下图所示。
,为检验溶液中所含的各阴离子,限用的试剂有:盐酸、硝酸、硝酸银溶液、硝酸钡溶液、溴水和酚酞试液。检验其中OH-的实验方法从略,检验其他阴离子的过程如下图所示。
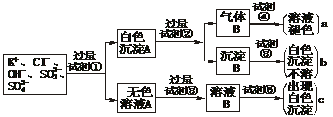
(1)图中试剂①-⑤溶质的化学式分别是:
①________,②________,③________,④________,⑤________。
(2)图中现象a、b、c表明检验出的离子分别是:a________、b________、c________。
(3)白色沉淀A加试剂②反应的离子方程式是_____________________。
(4)无色溶液A加试剂③的主要目的是___________________________。
(5)白色沉淀A若加试剂③而不加试剂②,对实验的影响是__________________。
(6)气体B通入试剂④发生反应的离子方程式是___________________________。
13.用惰性电极电解一定浓度的硫酸铜溶液,长时间通电后,向所得溶液中加入0.2mol Cu(OH)2,恰好恢复到电解前的浓度和pH。则电解过程中转移电子的总物质的量为
A.0.2mol B.0.4mol C.0.6mol D.0.8mol
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com