
题目列表(包括答案和解析)
11.用NA表示阿伏加德罗常数的值,下列说法中正确的是( )
A.6.2克白磷分子中含P-P键为0.05NA
B.10.0 mL 18.0mol/L的浓硫酸中氢离子数为0.36 NA
C.6.4 gS6与S8的混合物中所含S原子数一定为0.2 NA
D.80mL 10mol·L-1浓盐酸与足量MnO2反应,转移电子数为0.4NA
|
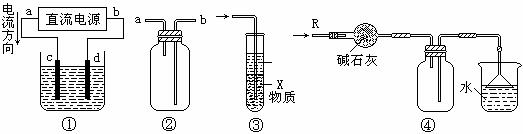 12.关于下列各装置图的叙述中,不正确的是( )
12.关于下列各装置图的叙述中,不正确的是( )
A.装置①中,d为阳极、c为阴极
B.装置②可用于收集H2、NH3、CO2、Cl2、HCl、NO2等气体
C.装置③中X若为四氯化碳,可用于吸收氨气或氯化氢,并防止倒吸
D.装置④可用于干燥、收集氨气,并吸收多余的氨气
10.下列有关溶液中所含物质或离子的检验,判断正确的是
A.加入AgNO3溶液生成的白色沉淀不溶于稀盐酸,则原溶液中一定有大量C1 存在
存在
B.加入BaCl2溶液,出现白色沉淀,加足量稀硝酸沉淀不溶解,则原溶液一定有大量SO42-或SO32-存在
C.加入盐酸有能使澄清石灰水变浑浊的的无色无味气体生成,则原溶液中-定有大量CO32-存在
D.加入氨水时生成白色沉淀,当氨水过量时白色沉淀完全消失,则原溶液中-定无Al3+存在
9.铅蓄电池效率低、污染大,现在研究用锌电池取代它,其电池反应为:2Zn + O2 2ZnO,其原料为锌、空气和电解质KOH溶液,则下列叙述正确的是:
2ZnO,其原料为锌、空气和电解质KOH溶液,则下列叙述正确的是:
A.锌为正极,空气进入负极反应 B.正极发生氧化反应,负极发生还原反应
C.负极的电极反应为:Zn-2e+2OH
 ZnO+H2O D.电池工作时溶液的pH降低
ZnO+H2O D.电池工作时溶液的pH降低
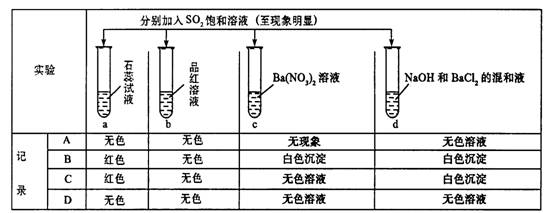
8.下列实验报告记录的实验现象正确的是
7.在元素周期表中,从左到右共有18列.第1列(除氢以外)为碱金属元素,稀有气体是第18列.下列说法中正确的是( )
A.第16列元素都是非金属元素 B.第14列元素形成的化合物都是+4价稳定
 C.第3列元素的种类最多 D.第7列元素的化合价有-l价
C.第3列元素的种类最多 D.第7列元素的化合价有-l价
6.能说明氯的非金属性比硫强的事实是①HClO的氧化性比H2SO4的氧化性强②常温下氯气是气态而硫是固态 ③氯气能溶于水而硫难溶于水 ④HCl比H2S稳定 ⑤H2S能被Cl2氧化成硫 ⑥HClO4酸性比H2SO4强 ⑦氯气与氢气化合比硫与氢气化合要容易进行 ⑧氯的最高价为+7价而硫的最高价为+6价
A.①②③④⑤⑥⑦⑧ B.①④⑤⑥⑦ C.④⑤⑥⑦⑧ D.④⑤⑥⑦
5.由于碘是卤素中原子半径较大的元素,可能呈现金属性。下列事实最能说明这个结论的是
A.已经制得了IBr、ICl等卤素互化物 B.已经制得了I2O5等碘的氧化物
C.碘(I2)易溶于KI等碘化物溶液,形成I 3-离子
D.已经制得了I(NO3)3、I(ClO4)3·2H2O等含I3+离子的离子化合物
4.类推的思维方法在化学学习与研究中有时会产生错误结论,因此类推的结论最终要经过实践的检验,才能决定其正确与否,下列几种类推结论中错误的是( )
①钠与水反应生成NaOH和H2;所有金属与水反应都生成碱和H2
②Fe3O4可写成FeO·Fe2O3;Pb3O4也可写成PbO·Pb2O3
③铝和硫直接化合可以得到Al2S3;铁和硫直接化合也可以得到 Fe2S3
④不能用电解熔融的AlCl3来制取金属铝;也不能用电解熔融的MgCl2来制取金属镁
A.①③④ B.②③ C②③④ D.①②③④
3.在含有I-离子且滴加酚酞显红色的溶液中,能大量共存的离子组是
A.SO42-、NO3-、Fe2+、Al3+ B.Na+、Ba2+、Cl-、AlO2-
C.Cl-、Na+、K+ 、ClO- D.NH4+、K+、Cl- 、SO32-
2.下列图象是从NaCl或CsCl晶体结构图中分割出来的部分结构图,试判断属于NaCl晶体结构的图象是
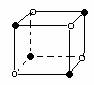
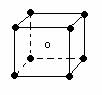
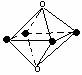
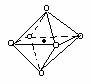
⑴ ⑵ ⑶ ⑷
A、图⑴和图⑶ B、图⑵和图⑶ C、图⑴和图⑷ D、只有图⑴
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com