
题目列表(包括答案和解析)
7.关工业生产的叙述中, 错误的是
A.制普通玻璃的主要原料是纯碱、石灰石、石英
B.氨是制作氮肥、硝酸、铵盐的重要原料
C.将二氧化硫催化氧化成三氧化硫后, 在吸收塔内用水吸收制得浓硫酸
D.制造普通水泥的主要原料是粘土、石灰石
6.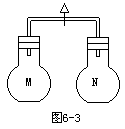 6-3,室温时,两个容积相同的烧瓶中分别盛有M和N两种气体(同温同压),当A处接通,使两烧瓶内气体相互接通后,容器内压强由大到小顺序正确的是
6-3,室温时,两个容积相同的烧瓶中分别盛有M和N两种气体(同温同压),当A处接通,使两烧瓶内气体相互接通后,容器内压强由大到小顺序正确的是
编号:① ② ③ ④
M H2S HCl SO2 NO
N SO2 NH3 O2 O2
A.④①③② B.④③①②
C.③④①② D.②④①③
5.下列物质间发生化学反应:①H2S+O2, ②Na+O2, ③Cu+HNO3,④P2O5+H2O,
⑤Fe+HCl, ⑥ Cu+S ⑦Na2CO3+HCl。在不同条件下得到不同产物的是 A.①②③④⑤ B.①③⑤⑦ C.①②③④⑦ D.①②③
4.
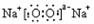
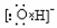
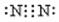
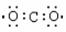 下列电子式书写错误的是
下列电子式书写错误的是
A. B. C. D.
3.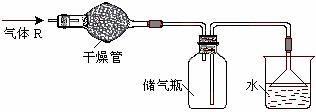 实验室里可按图所示的装置来干燥、收集气体R,多余的气体R可用水吸收,则R是
实验室里可按图所示的装置来干燥、收集气体R,多余的气体R可用水吸收,则R是
A.HCl
B.Cl2
C.CO
D.NH3
2.研究化学的基础,下图中所示的实验方法、装置或操作完全正确的是
A.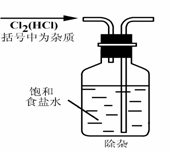 B.
B.
C.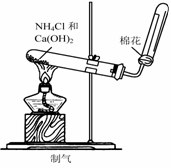 D.
D.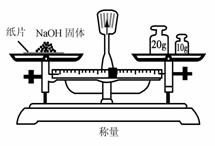
1.下列关于浓硫酸的叙述正确的是
A. 浓硫酸具有吸水性,因而能使蔗糖炭化
B. 浓硫酸在常温下可迅速与铜片反应放出二氧化硫气体
C. 浓硫酸是一种干燥剂,能够干燥氨气、氢气等气体
D. 浓硫酸在常温下能够使铁、铝等金属钝化
25.某学生为了测定某种稀硫酸的物质的量浓度,用不同质量的纯锌粉与该稀硫酸进行反应。他的六次实验结果如下(计算结果精确到0.1):
|
实验编号 |
加入锌粉的质量(g) |
稀硫酸溶液的体积(mL) |
生成硫酸锌的质量(g) |
|
1 |
2.0 |
50.0 |
5.0 |
|
2 |
4.0 |
50.0 |
|
|
3 |
6.0 |
50.0 |
14.9 |
|
4 |
8.0 |
50.0 |
19.3 |
|
5 |
10.0 |
50.0 |
|
|
6 |
12.0 |
50.0 |
19.3 |
 (1)其中第2、第5两个实验中生成硫酸锌的质量分别
(1)其中第2、第5两个实验中生成硫酸锌的质量分别
是 g、 g。
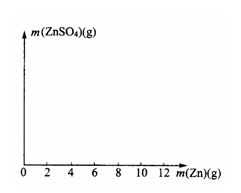
(2)在右图中画出生成硫酸锌的质量[m(ZnSO4)]与加入锌粉质量[m(Zn)]的关系示意图(需要标明关键点的横坐标和纵坐标的数据)。
(3)若使(10+m)g锌粉与50.0mL上述稀硫酸充分反应,剩余固体的质量为__________g,该稀硫酸的物质的量浓度为________mol/L。
24.有硫酸钾和碳酸镁的混合物,用50 mL 盐酸完全溶解后,在标准状况下收集到0.56L二氧化碳,向反应后的溶液中加入含有0.03 mol氢氧化钡的溶液,可得到6.11g沉淀,此时溶液的pH=12,溶液的体积为200mL,试求:
(1) 原混合物中碳酸镁的质量(2) 得到的沉淀中硫酸钡的质量(3) 盐酸的物质的量浓度
23.目前测定空气中SO2含量主要用氧化还原反应。已知SO2气体与酸性KMnO4溶液反应时,MnO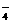 被还原为Mn2+,SO2被氧化成SO
被还原为Mn2+,SO2被氧化成SO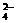 。为测定某地方的空气中SO2和可吸入颗粒的含量,甲同学设计了如下图所示的实验装置:
。为测定某地方的空气中SO2和可吸入颗粒的含量,甲同学设计了如下图所示的实验装置:
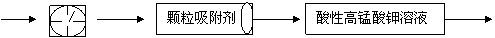


 ①其中: 或 表示密闭容器;
表示气体流速管(单位时间内通过
①其中: 或 表示密闭容器;
表示气体流速管(单位时间内通过

 气体的体积恒定,且无除尘和吸收气体作用); 表示棉花;颗粒吸附剂可以吸收可吸入的颗粒; 表示气体的流向。②酸性KMnO4溶液体积为200mL,浓度为0.1mol·L-1。
气体的体积恒定,且无除尘和吸收气体作用); 表示棉花;颗粒吸附剂可以吸收可吸入的颗粒; 表示气体的流向。②酸性KMnO4溶液体积为200mL,浓度为0.1mol·L-1。
回答下列问题:
(1)配制200mL0.1mol·L-1酸性KMnO4溶液,需用到的仪器按使用的先后顺序依次有 、玻璃棒、 、 、 。玻璃棒的作用是 。
(2)写出并配平测定SO2含量的离子方程式:
(3)若气体流速管中气体流速为a cm3/min,当t min时酸性KMnO4溶液恰好褪色,则空气中SO2的含量为 (g/cm3)。
(4)实验中棉花的作用是______________________________________________;
若要测定空气中可吸入颗粒的含量(g/L),还需要测出的数据是
。
(5)乙同学按照同样的方法测量空气中SO2的含量,所测得的数值总是比实际含量偏低,最可能的原因是(假设溶液配制、称量或量取及各种读数均无错误):
_______________________________________________________________。
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com